
Щелочная батарейка Duracell

Казалось бы, в мире гигагерцев и наносхем слово "батарейка" выглядят архаизмом. В действительности же, батарейки не только выжили, но и обеспечили энергией современный мир. Большинство из сегодняшних электронных устройстви игрушек - цифровые камеры, mp3 плееры, PDA, ноутбуки, - не могут обойтись без элементов питания.
Заметим, что современные батарейки сильно отличаются от своих прародителей. Требования современных устройств диктуют направления развития индустрии элементов питания. Производители прикладывают огромные усилия, чтобы минимизировать их размеры для обеспечения дальнейшей миниатюризации современной техники.
Последние инновации в производстве батареек направлены на удовлетворение нужд цифровых устройств. Дело в том, что современные цифровые камеры, цветные PDA, mp3 плееры работают несколько иначе, чем электрические фонарики или старинные радиоприёмники. Для работы вспышек и экранов, для воспроизведения глубоких басов, современные устройства используют очень сильный ток. Созданные по старым технологиям батарейки не выдерживают никакой критики при работе с большими уровнями токов. Хотя новейшие гальванические элементы и функционируют по давно известным принципам (разработанным еще сто лет назад), благодаря новым технологиям и материалам они обеспечивают все потребности современных устройств.
Производители батареек знают, что удвоить ёмкость элементов не так-то просто. Чудес не бывает. Принципы работы химических реакций, на которых основана работа батареек, всем давно известны. В настоящее же время производители совершенствуют технологии. Последнее значительное достижение химии - литий-полимерные батареи - хотя и известны уже около десяти лет, пока всё ещё остаются не у дел, так как ни разработчики компьютеров, ни производители батарей, не знают, как лучшим образом использовать весь потенциал этих элементов - например, их способность принимать разнообразные геометрические формы, нетрадиционные для обычных аккумуляторов.
Если на горизонте и появится что-то принципиально новое, то это будет энергетическая система, лишь внешне похожая на обычную батарейку. На самом деле это не совсем батарейка - это топливный элемент. Десятилетиями инженеры и ученые подходили к этой идее. Эта диковинка вырабатывает энергию химическими методами более эффективно, нежели другие. Такая батарейка ещё пока экзотика, и она очень дорога (и велика, к тому же) для повседневного использования. Тем не менее, как надеются некоторые производители, через несколько лет компьютеры и сотовые телефоны будут постоянно работать несколько дней без подзарядки.
Топливные элементы идеально подходят для персональных компьютеров. По прогнозам инженеров, ноутбук сможет работать на них 20 часов без подзарядки. Для того чтобы зарядить батарейку, вам просто придётся заполнить элемент жидким метанолом - эта несложная и безопасная операция обеспечит работу компьютера на том же самом элементе в течение следующих 20 часов.
Самое удивительное в этих прогнозах то, что инженеры считают такое возможным уже к концу 2001 года. С использованием этой же технологии сотовые телефоны придётся перезаряжать лишь раз в неделю. В конце концов, закончится это тем, что на такой энергии будут ездить автомобили, а кто-то, возможно, даже построит собственную электростанцию для обеспечения всех домашних нужд. И такое решение будет эффективнее традиционного и экологически чище.
Хотя топливные элементы и открывают новые перспективы, идея эта совсем не нова. Англичанин сэр Вильям Гроув (William Grove) первым разработал принципы функционирования топливных элементов в 1839. Начиная с 1960х NASA стала использовать щелочные топливные элементы в космосе. Уже сейчас серийно выпускаются электростанции на топливных элементах с мощностью до 200 кВт.
В действительности же, ещё в 1900 году инженеры предрекли великое будущее топливным элементам - они превзойдут другие технологии и станут главным источником энергии в промышленности и транспорте. Прошло всего сто лет. Как и многие другие великие идеи, эта была отложена - технологии того времени не могли обеспечить запросы науки. В частности, для того, чтобы разработать топливные батарейки для ноутбуков, пришлось ждать создания новых пластмасс и технологий их фабричного производства. Сегодняшняя дороговизна энергии и высокие требования к уровню загрязнения привели к тому, что начались исследования и коммерческое развитие новых топливных технологий. Топливные элементы долго созревали, и теперь они почти готовы выйти в широкое производство. Коммерческие изделия поступят в продажу уже в этом или следующем году.
Топливная батарейка никогда не изнашивается. Как и у обычной батарейки, у топливной есть и анод, и катод. Но в отличие от обычной, во время химических реакций масса электродов топливной батареи никогда не меняется: вместо этого, топливо служит в качестве источника свободных электронов и электрических полей, а электроды выполняют функции катализатора.
Как и обычные батареи, топливные элементы основываются на простой реакции окисления/восстановления (oxidation/reduction reaction), но реакция происходит в топливе, а не на электродах. Топливный элемент производит электроэнергию, пока в него поступает топливо (и пока элемент может избавляться от окисленного старого топлива). Анод в топливном элементе, как правило, опущен в топливо, а катод собирает и обеспечивает доступ к окислителю (часто в роли окислителя выступает атмосферный кислород). Прохождение реакции не влияет на электроды, так как между ними находится ионопроводящая мембрана.
У топливных элементов существует несколько преимуществ. Главное, эти элементы намного более эффективны по сравнению с любыми другими способами генерации электрической энергии, особенно с двигателями внутреннего сгорания. Эффективность уже существующих элементов составляет 50%, что в два раза выше ДВС (берущих начало с цикла Карно). Электроэнергия в элементах вырабатывается непосредственно из химических реакций, в этом случае не требуется промежуточных механических звеньев, используемых в большинстве электростанций (атомных, угольных, газовых) и также снижающих эффективность.
Кроме того, следует отметить экологическую чистоту и удобство топливных элементов. Движущихся частей в таких батареях либо вообще нет, либо крайне мало. Например, электростанции, работающие на топливных батареях, хотя и могут использовать топливные насосы, но топливные батареи не требуют коленчатых валов, поршней или клапанов. Портативные батареи вообще не имеют движущихся частей. Они не выделяют токсичных веществ и работают практически бесшумно.
Тем не менее, топливные элементы производят два типа выделений: тепловые и химические. Реакция окисления, происходящая внутри топливного элемента, похожа на реакцию горения. Таким образом, эта реакция, как и реакция горения, экзотермическая, то есть выделяет тепло. Во время работы топливные батарейки нагреваются. Элементы в батарее могут нагреваться до 50-100 градусов. Большие элементы, работающие на электростанциях, раскаляются до 1000 градусов. В таких случаях этому теплу находят применение - оно идёт либо на обогрев помещений, либо на подогрев воды.
Вдобавок ко всему, топливные элементы выделяют химические вещества - отработанное (окисленное) топливо. В отличие от отходов при других способах получения электроэнергии, эти химические отходы безвредны. В основном, экологически чистые элементы в качестве топлива используют чистый водород, который в паре с кислородом (в качестве естественного окислителя) выделяет в качестве отходов обыкновенную воду.
Элементы, использующие углеводородное топливо, такое как метанол, выделяют воду и углекислый газ, который затем попадёт в атмосферу. В отличие от ДВС, большинство топливных элементов работает при более низких температурах, а химические реакции тщательно контролируются. Поэтому они не засоряют воздух как ДВС: они просто не разогреваются до температуры, на которой вырабатывается закись азота.
Так как технологии по созданию топливных элементов появились сравнительно недавно, цена у топливных элементов выше, чем у других источников электроэнергии. Поэтому в массовую эксплуатацию они вводятся в основном из-за своих преимуществ - они экологически чистые и бесшумные. Высокая цена обуславливается зародышевым состоянием технологии производства этих элементов. Но благодаря интенсивному развитию технологий, в недалеком будущем цена на топливные элементы будет сопоставима с ценой на традиционные источники питания. В дальнейшем, быть может, они станут наиболее экономичным способом получения электроэнергии.
Самой обещающей технологией для питания портативных устройств, таких как ноутбуки и сотовые телефоны, пожалуй, является технология топливных батарей на метаноле (Direct Methanol Fuel Cell). Именно основываясь на этой технологии, Роберт Хокадэй (Robert Hockaday), физик Лос-Аламосской национальной лаборатории, разработал топливную микро-батарею, претендующую на коммерческий успех.
В соответствии с этой технологией элементы производятся следующим образом: создаётся тонкая слоистая плёнка, которая затем сворачивается в большой рулон и приобретает форму стандартных батареек. Основной недостаток метаноловых элементов заключается в токсичности топлива. Другие похожие технологии используют этанол (винный спирт), но их эффективность значительно ниже.
В скором будущем, топливные элементы станут очень популярны. По крайней мере, уже две компании - Siemens (в сотрудничестве с Фраунгоферовским институтом по установкам на солнечной энергии, Фрайбург, Германия) и Samsung продемонстрировали экспериментальные топливные батареи для портативных компьютеров. Компании показали потенциал технологий топливных элементов, но стоит отметить, что образцы были ручной сборки, и о массовом производстве речь не шла.
Ещё в 1990 году компания Хокадэя, Energy Related Devices Inc продемонстрировала экспериментальный сотовый телефон на топливных элементах. Это было первое устройство, проработавшее непрерывно 24 часа. При определённых доработках, это решение могло бы быть запущено в массовое производство. Некоторые компании, такие как PowerZyme LLC, публично предлагали наладить производство таких элементов к концу года. Но до настоящего времени ни один завод не объявил о начале массового производства топливных элементов питания для ноутбуков или сотовых телефонов.
Батареи имеют уже довольно большую историю, и у них ещё многое впереди. Сначала мы дадим краткую историческую справку о батареях и технологиях, затем мы окунемся в современные батарейные технологии. Как мы надеемся, эта статья поможет вам лучше понимать возможности батарей, их использование и обслуживание в портативных компьютерах, средствах связи и графических устройствах. Кроме того, мы расскажем о более экзотических технологиях, которые могут ждать нас в будущем.
Батарея - устройство для накопления энергии. Такое определение можно дать и маховику, и часовой пружине, и дровам. Однако когда речь идёт о современных технологиях, под батареей обычно понимают автономную химическую систему, производящую электроэнергию - портативный источник питания для фонариков, видеокамер, ноутбуков.
В компьютерных технологиях батареи находят себе следующее применение: в качестве источника питания ноутбуков, для хранения параметров BIOS, для систем бесперебойного питания и для беспроводных периферийных устройств, таких как мыши и клавиатуры. Каждая из этих областей выдвигает свои специфические требования к источникам питания. В итоге элементы отличаются не только размерами, формой, ценой, но также и химической технологией.
В других современных устройствах используются те же батарейки, что и в персональных компьютерах. Так, например, у сотовых телефонов такие же требования к источникам питания, что и у ноутбуков. Поэтому и элементы питания используются те же самые.
Общая черта современных батареек заключается в том, что все они основаны на химических реакциях, работающих по одному и тому же принципу. Эти внутренние реакции в терминах химии - редоксы - сокращение от reduction-oxidation - окислительно-восстановительные реакции. Это означает, что батареи работают за счет окисления и восстановления молекул - то есть за счёт перетягивания ионов кислорода от одних молекул к другим. Такой же процесс окисления происходит и при реакции горения. Только в этом случае реакция происходит быстрее и она менее контролируема.
Во время окислительно-восстановительных реакций (при освобождении электронов из молекул) вырабатывается побочный продукт - создаётся электрический ток, способный нагреть нить накала лампочки фонарика или обеспечить работу сложной электронной схемы в компьютере или другом устройстве.
По этому принципу работают все современные батареи. Анод и катод, созданные из различных материалов (строго говоря, они должны обладать различным окислительным потенциалом, его ещё часто обозначают как E0), связаны друг с другом посредством третьего материала, называемого электролитом. Выбор материала для обоих электродов и для электролита достаточно широк, именно поэтому мы видим такое разнообразие батарейных технологий. Кроме того, от выбора материала зависит энергетическая плотность элемента (то есть количество энергии, которую может хранить батарея определённого веса и размера) и номинальное выходное напряжение.
Вы можете создать элемент питания в домашних условиях - с помощью лимона, полоски цинка и полоски меди. Сложнее будет тем, у кого дома нет ни цинка, ни меди. :)
По всей вероятности элементы питания изобретали дважды. По данным археологов, еще доисторические люди пользовались электрохимическими элементами, которые сегодня мы бы назвали батарейками. В 1932 году в Багдаде было сделано интересное открытие: возможно, возраст элементов питания - около двух с половиной тысяч лет. Первый примитивный элемент питания состоял из железного стержня, опущенного в медный цилиндр. Предположительно, была еще и жидкость, служившая электролитом. Только она не сохранилась до наших дней. Такое устройство было немногим сложнее металлических полосок в лимоне, оно вырабатывало ток, достаточный для нанесения слоя ценных металлов гальваническим методом, что позволяло меди сверкать как золото или серебро.
Второй раз элементы питания были изобретены при изучении анатомии лягушек.
Началось всё с опытов итальянского физика и анатома Луиджи Гальвани (1737-1798), производимых в Болонском университете. Было замечено, что если подвергнуть мышцы на лапках лягушки воздействию статического электрического заряда (полученного с помощью лейденской банки), то они сокращаются. В опытах по биоэлектрогенезу (так были названы сокращения мышц, коленный рефлекс) Гальвани также заметил сокращение мышц, если к ним приложить два разных металла. Он сделал вывод, что мышцы вырабатывают электричество.
С тех пор имя Гальвани ассоциировано с электричеством - сегодня процесс получения электричества с помощью химических реакций называется гальванизмом (galvanism).
Более значительный вклад для истории элементов питания сделал друг Гальвани по переписке, итальянский физик Алессандро Вольта (1745-1827). Вольта работал в университете в Паве, там он достиг тех же результатов, что и Гальвани. Но Вольта на этом не успокоился и провел серию собственных экспериментов. Вольта создал первый элемент питания. После этого, их отношения с Гальвани несколько охладели.
Вольта сделал вывод, что причиной сокращения мышц лягушки стало электричество, вырабатываемое при соприкосновении двух различных металлов. Этот вывод противоположен выводу Гальвани. Чтобы доказать своё предположение, Вольта наполнил чашу соляным раствором и погрузил в неё две металлических дуги: одну - медную, вторую - цинковую. Это устройство, первый современный элемент питания, вырабатывало электричество за счет химических реакций металлов в растворах.
К 1800 году Вольта упростил устройство батареи. Теперь батарея представляла собой стопку пластинок, где между металлическими пластинками из меди или цинка находилась пластина из кожи, пропитанной раствором соли. В результате получилась так называемая гальваническая батарея, вырабатывающая электрический ток. Единица измерения электрического потенциала - Вольт - была названа в его честь.
Достижения Вольта были использованы и в дальнейших экспериментах по созданию новых элементов питания. Во-первых, была улучшена электрохимическая система Вольта. Например, в 1836 году английский химик Джон Фредерик Даниел поместил свинец и цинк в сосуд с серной кислотой, так возник плоскостный элемент или элемент Даниела. Тремя годами позже, Вильям Роберт Гроув добавил окислительный агент, чтобы скапливающийся на катоде во время работы элемента водород не уменьшал напряжение. В двухсоставном элементе питания Гроува анод из амальгамированного цинка погружался в неполяризующийся электрод с серной кислотой, который, в свою очередь, помещался во второй сосуд, содержащий азотную кислоту и платиновый катод.
Немецкий химик Роберт Вильгельм Бунзен (более известный как создатель бунзеновской горелки, а не как исследователь электричества) доработал в 1841 году элемент Гроува - он заменил дорогой платиновый электрод дешевым угольным.
Ни один из этих примитивных элементов не дожил до наших дней. Первое значительное изобретение сделал Гастон Плантэ, разработавший в 1859 году во Франции свинцовый аккумулятор. Впервые элемент питания обрел успех. Это была подзаряжаемая батарея. Похожие электрохимические элементы с доработанной упаковкой используются в современных автомобильных аккумуляторах. Кроме того, такие же элементы, заправляющиеся желеобразным электролитом, используются в системах бесперебойного питания.
Следующим важным достижением было создание жидкостных элементов. Впервые они были изобретены и запатентованы Джорджем Леклончем в 1866 году. Леклонч использовал катоды из диоксида марганца, смешанного с углем и цинковые аноды в форме стержня. В качестве электролита использовался раствор нашатыря. Технология Леклонча дожила и до настоящего времени в виде самых дешевых элементов - углецинковых - использующихся в электрических фонариках.
Но такие элементы, в том виде, в каком они были изобретены, были громоздкими и непрактичными. Кое-кто пытался их герметизировать. Так, например, в 1881 году Ж.А.Тибо (J.A.Thiebaut) предотвратил вытекание жидкого электролита, поместив и цинковый катод, и электролит в манжетный уплотнитель. А современная пластмасса сделала технологию Леклонча незаменимой в некоторых областях. Одноразовые батарейки PolaPulse (производства Polaroid), работающие в фотокомплектах одноступенного процесса используют химические процессы, разработанные Леклончем, только они выполнены в другой оболочке.
Напряжение описывает электрический потенциал батареек, от него зависит сила, действующая на электроны в электрической цепи. Существует ещё один физический термин - электродвижущая сила, ЭДС. С другой стороны, электрический ток характеризуется количеством электронов, которое может обеспечить электрический потенциал. Электрический ток измеряется в амперах, в честь французского физика и математика Андре Мари Ампера (1775-1836). Мощность - произведение напряжения и силы электрического тока - измеряется в Ваттах, в честь шотландского инженера-изобретателя Джеймса Уатта(1736-1819).
Напряжение у батареек с одной стороны, остаётся постоянным, с другой стороны, постоянно изменяется. Попробуем объяснить эту фразу: напряжение характеризуют химические реакции, протекающие в батареях, и эти реакции не изменяются. Но кроме этого, напряжение зависит и от температурного режима, в котором работает элемент питания (в большинстве батарей при снижении рабочей температуры падает и напряжение), и от возраста батарейки (чем она старее, тем меньше напряжение), и от нагрузки (чем больше тока они расходуют, тем меньше становится напряжение).
В результате всех этих факторов, реальное напряжение может значительно отличаться от номинального. В начале своей жизни элементы питания могут давать напряжение до 1,8 вольт и могут оставаться годными к использованию, пока напряжение не упадёт до 0,8 вольт. Из-за такого широкого разброса современные устройства либо разрабатываются не чувствительными к напряжению, либо просто регулируют его, и внутренние схемы всегда получают одинаковое напряжение. Именно поэтому вы можете использовать и углецинковые (с номинальным напряжением 1,5 вольт), и никель-кадмиевые (1,2 вольта), и литиевые дисульфидные (lithium disulfide - 1,6 вольт) элементы.
В зависимости от химических реакций одинаковые элементы могут давать напряжение от доли вольта, до более чем трёх вольт. Элементы, дающее напряжение выше трёх вольт, как правило, составные. (Хотя мы и привыкли называть батарейкой любой элемент питания, с технической точки зрения термин "батарея" означает собрание нескольких отдельных электрохимических элементов.)
Из-за своего устройства, элементы питания дают ограниченный электрический ток. Теоретически, если бы химическая реакция в элементе протекала мгновенно, элемент за это время мог выработать, скажем, неограниченный ток. Но существуют факторы, ограничивающие скорость прохождения химических реакций, а, следовательно, и производимый ток. Основными факторами являются скорость реакции химических элементов, устройство элемента и площадь, на которой протекают эти химические реакции.
Соответственно, существуют и элементы, способные создавать большой ток и элементы, создающие только слабые токи. Например, ток, вырабатываемый свинцовыми аккумуляторами и никель-кадмиевыми батареями, настолько велик, что при коротком замыкании можно плавить металл и зажечь огонь! Если положить никель-кадмиевую батарейку в карман, она может замкнуться о ключи или мелочь, а при замыкании при таких высоких токах существует вероятность воспламенения. Поэтому, обычно на таких батарейках можно прочесть предупреждения.
Размер элементов питания определяет выбор химических реакций, а, следовательно, влияет и на вырабатываемый ток. Чем больше размер элемента, тем больший ток он способен выработать. Поэтому сверхмощные устройства зачастую требуют более крупных элементов. Батарейки размера "D" производят больше тока, чем батарейки размера "AA".
Все эти различные факторы можно свести к одному: на вырабатываемый ток влияет эквивалентное внутреннее сопротивление элемента. Чем оно ниже, тем выше ток.
Емкость батарейки вычисляется как количество электричества, или электрического заряда, вырабатываемого при определённых условиях полностью заряженной батарейкой. Как и с напряжением, реальный заряд батарейки изменяется в зависимости от температуры и тока разрядки.
В науке единицей измерения емкости батареек является кулон (в честь французского физика Шарля Огюстена Кулона, 1736-1806). Именно ёмкость описывает количество времени, в течение которого элемент питания способен вырабатывать определённый электрический ток. Один кулон равен одному амперу, произведённому за одну секунду. На практике же, обычно, ёмкость батареек измеряется в ампер-часах, что в 3600 раз больше кулона. Общее количество энергии батарейки вычисляется как ёмкость, умноженная на напряжение, и измеряется в ватт-часах.
Батарейки не могут хранить энергию вечность. Химические элементы в батарейках неминуемо вступают в реакцию и постепенно портятся. В результате разряжается сама батарейка. Разряд батарейки может происходить в двух формах.
Некоторые химические реакции постоянно влияют на способность элементов хранить химическую энергию. Через некоторое время элементы питания теряют заряд и превращаются в тяжелые красиво раскрашенные цилиндры. Время, в течение которого элементы сохраняют работоспособность, называется сроком годности. Срок годности определяется устройством батареек, химическими реакциями и условиями хранения. Некоторые батарейки, такие как современные литиевые, имеют срок годности, превышающий десятилетие, некоторые же портятся в считанные недели (например, цинково-воздушные - после начала эксплуатации). Плохие условия хранения - особенно высокие температуры - ускоряют разряд батареек. Если же хранить элементы питания в холодных условиях, срок их годности увеличится.
В подзаряжаемых элементах обратимые химические реакции, в результате которых создаётся электричество, протекают, даже если не использовать батарейку. Правда, скорость таких реакций невелика. Такое явление получило название саморазряда. Как и после обыкновенного разряда, батарейку можно будет просто подзарядить. Скорость такого саморазряда зависит от тех же факторов, от каких зависит и срок годности батареек. Хотя в современных батарейках основными факторами являются всё же устройство и типы химических реакций. Например, некоторые химические составы теряют до десяти процентов заряда в день, а некоторые - менее процента.
Соотношение ёмкости к весу (размеру) батарейки называют плотностью батарейки. Чем она выше, тем большее количество энергии может вырабатывать элемент определённого размера и веса, и соответственно тем больше такой элемент востребован - по крайней мере, если вам доводилось целый день носить с собой ноутбук с батарейкой, то вы поймёте. В следующей таблице представлена плотность элементов большинства химических типов для персональных компьютеров и сотовых телефонов. Плотность представлена ватт-часами на килограмм.
| Тип элемента | Номинальное напряжение | Энергетическая плотность |
| Свинцовый | 2,1 В | 30 Вт/кг |
| Никель-кадминевый | 1,2 В | 40-60 Вт/кг |
| Никель-металлгидридные | 1,2 В | 60 to 80 Вт/кг |
| Цилиндрический литий-ионный | 3,6 В | 90-100 Вт/кг |
| Прямоугольный литий-ионный | 3,6 В | 100-110 Вт/кг |
| Полимерный литий-ионный | 3,6 В | 130-150 Вт/кг |
Далее будут рассмотрены - устройство элементов питания, углецинковые, свинцовые, никель-кадмиевые, никель-металлгидридные, литий-ионные аккумуляторы, литий полимерные и литий-железодисульфидные элементы, цинково-воздушные аккумуляторы, технологии подзарядки. А так же - системы обеспечения бесперебойного питания, питание периферийных устройств, батарейки материнских плат и т.д...
Батарейки - это химические устройства, но мы часто забываем об их происхождении - ведь вся химия, как правило, скрыта от глаз. Нам видны лишь различия в размере и в напряжении.
Наверное, каждый, кто получал в подарок устройство без батареек, оценивал размер элементов. Как правило, батареек нужного размера никогда нет под рукой. Огромное разнообразие стандартов всё же лучше их полного отсутствия. Например, большинство батареек для ноутбуков не стандартизованы, и как следствие, очень дороги. Во многих случаях вы становитесь заложниками производителей батарей, заложниками их ценовой политики. В принципе, существуют сторонние производители, предлагающие подзаряжаемые батареи. Многие с недоверием относятся к качеству, безопасности и сроку службы таких элементов питания, хотя в большинстве случаев они успешно справляются с задачами. Батареи же стандартных размеров в большом ассортименте представлены многими производителями, к тому же, такие элементы значительно дешевле аккумуляторов.
Основные современные стандарты распространяются на углецинковые элементы. В принципе, другие технологии (некоторые разновидности литиевых, никель-кадмиевых, и никель-металлгидридных элементов) также следуют этим же стандартам. В стандартах определяются размеры батареей. Таким образом, устройства могут работать на батарейках от различных производителей. В следующей таблице приведены стандартные размеры батареек.
| Тип элемента | Форма | Высота | Диаметр |
| AAAA | Цилиндрическая | 42,5 мм | 8,3 мм |
| AAA | Цилиндрическая | 44,5 мм | 10,5 мм |
| AA | Цилиндрическая | 50,5 мм | 14,5 мм |
| C | Цилиндрическая | 50,0 мм | 26,2 мм |
| D | Цилиндрическая | 61,5 мм | 34,2 мм |
| J | Прямоугольная | 48,5 мм | 33,5 x 9,2 мм |
| N | Цилиндрическая | 29,35 мм | 11,95 мм |
| 9В | Прямоугольная | 48,5 мм | 26,5 x 17,5 мм |
Несмотря на использование различных химических процессов, электрические показатели у них одинаковые. Поэтому они взаимозаменяемы не только по размерам, но и по электрическим параметрам. При этом следует заметить, что это не означает их полной идентичности - все слабые и сильные стороны проявляются в конкретных применениях.
Прогресс в батарейной технологии не мог ждать появления новых пластмасс. Поэтому, ученые пошли другим путём - они разработали химические процессы, позволяющие избежать использования неудобных жидкостей вообще. Заслуга в создании удобных сухих элементов принадлежит Карлу Гасснеру из города Майнца. Он запатентовал сухие элементы ещё в 1887 году. Несмотря на различные технологические доработки, современные сухие элементы всё же основаны на концепции, разработанной Гасснером.
Большинство современных экзотичных подзаряжаемых батарей - никель-кадмиевые, никель-металлгидридные, множество литиевых батарей - это разработки двадцатого века, результаты исследований различных лабораторий крупных корпораций и университетов. Принципы устройства и работы батарей давно известны, поэтому новых химических процессов экспериментальным путём никто не придумал. Основные же работы ведутся в области усовершенствования и оптимизации химических процессов.
С точки зрения химии, гальванические элементы разделяются на два типа: первичные и вторичные. То есть одноразового и многоразового использования. Различаются они способами вырабатывания энергии.
В одноразовых элементах электричество вырабатывается из химической реакции, постоянно изменяющей элемент питания. В процессе разрядки - извлечения электричества из элемента - анод, катод и электролит необратимо изменяются. В таком случае после разрядки элемент попадает на пункт приёма вторсырья.
В перезаряжаемых элементах химические реакции могут протекать и в обратном направлении, при этом элемент будет накапливать электричество, а не тратить его. В отличие от первого типа, эти элементы аккумулируют электричество, потому и называются аккумуляторными батареями. Ещё их называют подзаряжаемыми (rechargable).
При прочих равных такие батареи кажутся лучше. Они уменьшают количество вредных химикалий, попадающих на свалку, так как вы не выкидываете их при разрядке. Но по практическому сравнению с обычными элементами, у подзаряжаемых элементов имеется несколько недостатков.
Химическое устройство подзаряжаемых элементов зачастую менее удобно, чем у обыкновенных элементов. Например, большинство подзаряжаемых элементов работает на агрессивных жидкостях, которые сложнее хранить - они менее стабильны. Инженеры создали одноразовые элементы, остающиеся годными даже через десять лет хранения. Что же касается аккумуляторов, практически все они сравнительно быстро теряют свой заряд. Немногие аккумуляторы сохраняют хотя бы часть своего изначального заряда через год работы или бездействия.
Перед тем как использовать, аккумуляторы необходимо заряжать, а это требует источника электричества нужного напряжения и нужного тока. В некоторых устройствах использование аккумуляторов не оправдано с практической точки зрения. Особенно, когда речь идёт о максимально дешевых переносных устройствах. Согласитесь, доплачивать 10 долларов за зарядное устройство для аккумуляторов к игрушке или фонарику за 2 доллара явно не имеет смысла.
В экстремальных ситуациях более удобны простые гальванические (одноразовые) элементы - они всегда готовы к использованию и практически целиком заряжены. Для часто используемых устройств более эффективно использовать аккумуляторы (как правило, из экономических соображений).
Важнейшим фактором при разработке батареек считается количество энергии, которое может хранить элемент определенного размера. Ведь источник питания должен обеспечивать работу устройства, по крайней мере, какое-то определённое время. Химические реакции, протекающие в элементе - наиболее важный фактор, определяющий энергетическую плотность и полезность батарейки. История батареек, на самом деле, это история поиска и улучшения химических реакций для увеличения плотности.
Сегодняшние батарейки используют множество различных химических реакций. Некоторые были описаны ещё в конце 19 века, некоторым едва исполнилось десять лет. Каждая из них обладает своими преимуществами при использовании в различных видах устройств. Далее мы рассмотрим наиболее популярные типы химических батарей для ноутбуков, сотовых телефонов, систем питания и периферийных устройств.
Батарейные технологии начинают отсчет именно с этого типа. Прообраз этого элемента был изобретён в 1866 году Джорджем Леклончем. Углецинковые элементы считаются наиболее распространёнными и имеют множество различных названий. Когда вы говорите о батарейках, вы, скорее всего, имеете в виду именно эти батарейки. К слову сказать, одна только компания - Energizer - за год продаёт шесть миллиардов таких элементов. На сегодняшний день, это самые дешевые элементы, кроме того, это элементы с наименьшей плотностью среди большинства батареек.
Причиной их популярности стали названные химические процессы. К числу таких батареек относятся элементы Леклонча, цинк-хлоридные и щелочные элементы.
В углецинковом элементе катодный токосъемник изготовлен из угля. Он представляет собой угольный стержень, проходящий по оси батарейки. На самом деле катод состоит из смеси диоксида марганца, угля и электролита. Анод выполнен из цинка и представляет собой сам корпус элемента питания. Электролит - это сложная смесь химикалий (клейстер), обычно включающая нашатырь, диоксид марганца и хлорид цинка.
Элементы Леклонча и цинк-хлоридные элементы отличаются в основном электролитом. В первом типе в качестве электролита используется разбавленная водой смесь нашатыря и хлорида цинка. В цинк-хлоридных, в основном, это хлорид цинка. Напряжение в цинк-хлоридных элементах немного больше, чем в элементах Леклонча - 1,6 Вольта, против 1,55.
Несмотря на то, что цинк-хлоридные элементы и имеют большую емкость, нежели элементы Леклонча, это разница незаметна при небольших нагрузках. Поэтому цинк-хлоридные элементы часто называют сверхмощными. В любом случае, чем выше нагрузки, тем меньше эффективность углецинковых элементов. Скажем, при увеличении тока нагрузки в два раза, емкость батарейки сокращается более чем наполовину. Поэтому чем больше тока потребляет устройство, тем больше будет размер батарейки. Именно поэтому прожорливые в энергетическом смысле устройства работают на элементах размера "D", а маломощные радиоприёмники будут работать и на элементах "АА".
Щелочные элементы (независимо от того, что говорят в рекламе) - это все лишь небольшое улучшение углецинковой технологии 19 века. Основные изменения коснулись химического состава электролита - он стал более щелочной (а чего ещё вы ожидали?). Такое изменение позволило увеличить плотность и срок годности элементов питания.
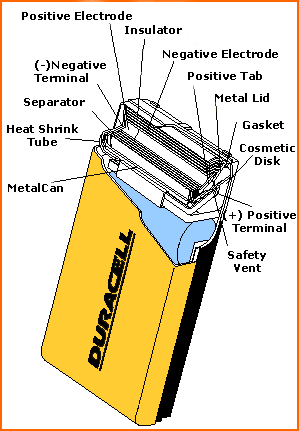
Конструкция же щелочных элементов во многом отличается от конструкции обычных углецинковых. Для улучшения эффективности, их устройство было кардинально изменено. Корпус щелочных элементов служит просто для защиты, и не играет никакой роли в химических реакциях. Анод этих элементов представляет желеобразную смесь активного цинка и электролита (который сам по себе представляет смесь гидроксида калия (являющегося щелочью) и воды). Оба этих компонента связаны с отрицательным полюсом элемента с помощью медного стержня, проходящего по оси элемента. Катод, смесь угля и диоксида марганца, размещается вокруг анода и электролита и отделяется слоем нетканого материала вроде полиэфира. На рисунке представлена конструкция щелочного элемента Duracell.

В зависимости от сферы применения, щелочные элементы могут работать в 4-9 раза дольше обыкновенных углецинковых элементов. Преимущество их неоспоримо при редко возникающих больших нагрузках, то есть если мощное устройство работает около часа в день, а не по несколько минут каждый час.
Номинальное напряжение углецинковых элементов - 1,5 Вольта. Но это напряжение обеспечено лишь при небольших токах в самом начале их эксплуатации. Напряжение уменьшается при увеличении нагрузки и при уменьшении заряда.
В стандартных девятивольтных батарейках используются те же химические реакции. Для обеспечения такого напряжения внутри каждой батарейки последовательно соединяется шесть углецинковых элементов. В принципе, подобным образом можно достичь ещё большего напряжения. В пятидесятых годах для работы ламповых приёмников батарейки давали напряжение от 45 до 90 Вольт. Они тоже состояли из углецинковых элементов.
Как правило, щелочные батарейки не подзаряжаются. В них не могут протекать обратные химические реакции. Если же вы попытаетесь подзарядить обычную углецинковую батарейку, она скорее станет работать как резистор, а не как аккумулятор и будет просто нагреваться. При очень сильном токе батарейка разогреется до состояния, при котором возможен взрыв - хороший повод никогда не экспериментировать с подзарядкой углецинковых или щелочных элементов.
Как и у любого правила, здесь тоже есть исключения - восстанавливаемые батарейки Renewak, производимые по лицензии корпорации Rayovac Corporation (данная технология возникла сравнительно недавно). Устройство этих батареек основано на двух углецинковых технологиях, оно отличается от устройства обыкновенных батареек. Что важно, для зарядки таких батареек требуются специальные зарядные устройства. Вместо обыкновенного постоянного тока их заряжают пульсирующим током. В зарядных устройствах эти импульсы управляются микропроцессором, именно он определяет, когда нужно дать напряжение и защищает батарейку от перегрева. Но даже такие нестандартные зарядные устройства не обеспечивают батарейкам долгой жизни. Обычно её хватает на 25-100 перезарядок. Тем временем цена на такие элементы в два раза выше, чем на обыкновенные щелочные. Но в некоторых случаях их использование может быть экономически оправдано.
Большинство аккумуляторов в мире - свинцовые. В основном их используют для пуска двигателей автомобилей. Прообразом этих элементов стали разработки Плантэ. В них также есть аноды, сделанные из ячеистого свинца, и катоды - из оксида свинца. Оба электрода погружены в электролит - серную кислоту.
Из-за свинца эти батареи очень тяжелы. А так как они залиты высококоррозийной кислотой (которая также утяжеляет аккумуляторы), они становятся ещё и опасными, требующими особого внимания. Кислота и испарения могут повредить соседствующие объекты (особенно металлические). А если переусердствовать с зарядкой, может начаться электролиз воды, находящейся в кислоте. При этом вырабатывается водород, взрывоопасный газ, который при определённых условиях может взорваться (как в случае взрывов Хинденбурга).
Разложение воды в батарее может привести и к другому эффекту: ведь общее количество воды в батарее уменьшается. При этом уменьшается площадь реакции внутри батареи, соответственно, уменьшается и емкость аккумулятора. Кроме того, уменьшение жидкости позволяет батарее разряжаться под воздействием атмосферы. Электроды могут шелушиться и вообще закоротить батарею.
Первые свинцовые аккумуляторы требовали регулярного ухода - было необходимо поддерживать нужный уровень воды/кислоты внутри каждого элемента. Так как в батарее подвергается электролизу только вода, заменять необходимо только её. Чтобы избежать загрязнения батареи, производители рекомендуют использовать для обслуживания только дистиллированную воду. Обычно батарею доливают до нормального уровня. Если на батарее нет метки, её необходимо доливать так, чтобы жидкость закрывала пластины электродов внутри.
В неподвижных устройствах, корпус у батарей выполнен из стекла. Оно не только хорошо держит кислоту, но и позволяет обслуживающему персоналу без особых трудностей определять состояние элементов. В автомобильной технике требуются более прочные корпуса. Инженеры для этих целей воспользовались эбонитом или пластиком.
После того, как элементы стали герметизировать, удобство использования таких свинцовых аккумуляторов стало бесценным. В результате появились так называемые необслуживаемые батареи. Так как испарения так и остаются внутри элементов, потери от электролиза сводятся к минимуму. Поэтому такие батареи и не требуют заправки водой (по крайней мере, не должны).
Но это не значит, что у таких батарей вовсе не возникает проблем с обслуживанием. Всё равно внутри плещется кислота. И эта кислота может вытечь через батарейные клапаны. При этом могут повредиться батарейные отсеки или даже оборудование, где она установлена. Инженеры избегают такой ситуации двумя способами. Можно содержать кислоту внутри пластикового сепаратора между электродами элемента (обычно, он сделан из микропористого полиолефина или полиэтилена). Либо можно смешать электролит с другим веществом, чтобы в результате получился гель - например, с коллоидальной массой наподобие желатина. В результате утечка не происходит.
Кроме опасной начинки, у свинцовых батарей есть и другие недостатки. Как было отмечено выше, они очень тяжелые. Количество энергии, которое содержится в единице массы у таких батарей меньше, чем в батареях практически любых других технологий. Это единственное, чем не удовлетворены создатели автомобилей, которые бы с большим удовольствием использовали эти недорогие свинцовые батареи в электрокарах.
С другой стороны, хотя эти батареи и дешевые, они насчитывают 150 летнюю историю. Технология позволяет модернизировать аккумуляторы для специальных нужд, например для использования в устройствах с большими циклами разряда (где батареи используются в качестве единственного источника питания) или в устройствах обеспечения бесперебойного питания, например, в больших центрах обработки информации. Свинцовые батареи также обладают низким внутренним сопротивлением и поэтому могут вырабатывать очень большие токи. В отличие от более экзотичных элементов, к примеру, никель-кадмиевых, они не подвержены эффекту памяти. (Этот эффект, применительно к никель-кадмиевым элементам, сокращает емкость батареи, если перезаряжать её ещё до того, как она полностью разрядится.) Кроме того, такие батареи достаточно долго живут и они предсказуемы. И, конечно же, они дешевы.
В большинстве таких источников используются свинцовые аккумуляторы с желеобразным электролитом. Обычно, такие устройства неприхотливы в обслуживании. Это значит, вы не задумываетесь об их обслуживании. Источники питания, тем не менее, довольно громоздки - ведь внутри находятся аккумуляторы. Будучи полностью заряженными, элементы с желеобразным электролитом постепенно портятся под воздействием постоянного слаботочного заряда. (Большинство свинцовых аккумуляторов содержатся в полностью заряженном состоянии). Поэтому такие элементы требуют специальных зарядных устройств, которые бы автоматически отключались, как только элемент полностью зарядится. Зарядное устройство должно снова включаться, как только аккумулятор разрядится до предопределённого уровня (не важно, под воздействием ли нагрузки, или в результате саморазряда). Обычно источники бесперебойного питания регулярно проверяют заряд аккумулятора.
В потребительской электронике, большинство аккумуляторов - никель-кадмиевые. Это самый популярный тип подзаряжаемых батареек. Обычно их обозначают NiCad. Катоды в таких элементах сделаны из никеля, а аноды - кадмиевые. Больше всего в таких элементах ценится их емкость и способность перезаряжаться большое количество раз. Обычно такие элементы остаются пригодными к работе даже после 500-1000 циклов перезарядки. Кроме того, такие элементы относительно легки, и имеют довольно высокую плотность (хотя она в два раза меньше обычных щелочных). Таким элементам не страшна непрерывная подзарядка (по крайней мере, при правильном осуществлении). Минусом в никаль-кадмиевых элементах считается их токсичность (кадмий - яд) - об этом можно прочесть на обечайке.
Выходное напряжение большинства химических элементов уменьшается по мере разряда. Это происходит по причине того, что реакции, происходящие внутри батарейки, увеличивают её внутреннее сопротивление. Никель-кадмиевые элементы обладают очень низким внутренним сопротивлением, а это означает, они могут вырабатывать высокие токи, которые не сильно изменяются по мере разрядки батарейки. Соответственно, такие элементы могут создавать практически постоянное напряжение до тех пор, пока целиком не разрядятся. Как только такие элементы разряжаются целиком, напряжение резко падает.
Такое постоянное напряжение очень ценится разработчиками электроники - теперь им не приходится создавать вариаторы напряжения. Но эта же черта не позволяет вычислять степень заряда батарейки. В результате, большинство ноутбуков, к примеру, не проверяют состояние батарейки каждый раз, а вычисляют степень заряда аккумулятора исходя из количества часов, которое она проработала, и её номинальной емкости.
Ещё одним недостатком никель-кадмиевых батареек считается эффект памяти. Некоторые элементы, не будучи полностью разряженными, при дозарядке могут терять мощность. Химия объясняет такой эффект просто - в результате преждевременной перезарядки на анодах элементов возникают кристаллы кадмия, уменьшающие площадь реакции. Возникновение этих кристаллов называется эффектом химической памяти. Такая химическая память запоминает вторичное состояние разряда аккумулятора. Когда батарейка разряжается до этого состояния, мощность батарейки резко падает, даже несмотря на оставшуюся емкость. Если такой элемент продолжать заряжать из этого состояния, ситуация только усугубится - будет сложнее привести аккумулятор в нормальное состояние. При последующих циклах перезарядки из этого состояния батарея ещё лучше его "запомнит". Для того же, чтобы целиком восстановить емкость аккумулятора и избавиться от этого эффекта запоминания, необходимо разряжать аккумулятор так, чтобы он миновал состояние вторичного разряда.
С практической стороны, вылечить аккумулятор можно сильно разрядив его - до уровня, чтобы он едва работал, и затем целиком зарядив его. Но это не означает, что нужно полностью разряжать аккумулятор. Так можно испортить практически любой элемент. Например, если разряжать никель-кадмиевый аккумулятор до напряжения одного вольта (при номинальном напряжении в 1,2) - то можно его погубить. Ноутбуки же отключаются еще до того, как батарейка полностью разряжается. Поэтому можно не заботиться о чрезмерной разрядке батареек. И еще: не пытайтесь разрядить аккумулятор с помощью короткого замыкания - вы рискуете испортить батарею и устроить пожар.
Хотя практикой это и не подтверждается, но если верить производителям батарей, современные никель-кадмиевые и никель-металлгидридные батарейки лишены этого недостатка. Некоторые производители литиевых элементов утверждают, что эффект памяти образуется под воздействием никеля, а не кадмия. С таким выводом не согласны химики, а пользовательский опыт наводит на противоречивые сведения.
В любом случае, для эффективного использования никель-кадмиевых аккумуляторов, для обеспечения максимального срока службы, лучше пользоваться ими равномерно, по нормальному циклу. Заряжать полностью, и использовать до нормального уровня разряда, затем снова заряжать до конца.
Как и в свинцовых аккумуляторах, в никель-кадмиевых батарейках возможен электролиз - распад воды в электролите на потенциально взрывоопасные водород и кислород. Производители батареек предпринимают различные меры для предотвращения этого эффекта. Обычно элементы для предотвращения утечки герметично упаковывают. Кроме того, батарейки устроены так, чтобы сначала вырабатывался не водород, а кислород, который предотвращает реакцию электролиза.
Для того чтобы герметичные аккумуляторы не взрывались, и чтобы в них не скапливался газ, обычно в батарейках предусматривают клапаны. Если закрыть эти вентиляционные отверстия, то возникнет опасность взрыва. Обычно эти отверстия настолько малы, что остаются незамеченными. Работают они автоматически. Это предостережение (не закрывать вентиляционные отверстия) относятся в основном к производителям устройств. Стандартные отсеки для батареек предполагают возможность вентиляции, но вот если залить батарейку в эпоксидной смоле, то вентиляции не будет.
С точки зрения химии, лучшим материалом для катода батареек был бы водород. Но создать такой катод проблематично. При обычных температуре и давлении водород легче воздуха, и его очень трудно удержать.
В конце шестидесятых ученые обнаружили, что некоторые металлические сплавы позволяют хранить атомарный водород в объёмах, в тысячи раз превосходящие собственные. Эти сплавы называются гидридами и обычно состоят из таких соединений как LiNi5 или ZrNi2. В хорошо продуманных системах гидриды могут позволить хранить много водорода, который может вступить в обратимые реакции.
В большинство аккумуляторов, использующих гидридные катоды, аноды сделаны из никеля - как и в никель-кадмиевых. Обычно в качестве электролита в таких элементах используется разбавленный раствор гидроксида калия, щелочь по природе. На рисунке представлено устройство никель-металлгидридной батарейки Duracell.
При замене кадмия гидридом достигаются некоторые преимущества. Во-первых, конечно же, это удаление токсичного кадмия. Отсутствие кадмия означает также и то, что у аккумулятора не должен наблюдаться эффект памяти. Вдобавок, использование водорода в катодах приводит к тому, что плотность у аккумуляторов повышается на пятьдесят процентов в сравнении с никель-кадмиевыми элементами. Практически это означает, что батарейка такого же размера и такого же веса может питать ноутбук в полтора раза дольше.
Никель-металлгидридные аккумуляторы, часто обозначаемые как Ni-MH, всё же не совершенны. Основным недостатком таких элементов является большая, в сравнении с никель-кадмиевыми элементами, скорость саморазряда. Некоторые никель-металлгидридные элементы теряют до пяти процентов своей емкости за сутки. Заметьте, это показатели современных аккумуляторов.
Как и в никель-кадмиевых элементах, в никель-металлгидридных выходное напряжение составляет 1,2 вольта, и оно остаётся относительно постоянным в течение всего цикла разряда. При дальнейшем разряде оно резко падает. (В полностью заряженном состоянии никель-металлгидридные элементы вырабатывают напряжение в 1,4 вольта, но оно быстро снижается до 1,2 - такой уровень считается основным на протяжении всего цикла разрядки.)
Во многих случаях никель-металлгидридные аккумуляторы можно заменять никель-кадмиевыми. У них практически одинаковые электрические показатели - и те, и другие способны вырабатывать высокие токи, хотя у никель-кадмиевых этот показатель и выше. Никель-металлгидридные аккумуляторы могут выдержать большое количество циклов подзарядки, обычно до 500, но всё равно с никель-кадмиевыми их не сравнить.
Несмотря на то, что характеристики разряда никель-металлгидридных и никель-кадмиевых элементов практически одинаковы, процесс заряда этих аккумуляторов различен. Особенно эта разница заметна в тепловых режимах - никель-кадмиевые аккумуляторы эндотермичны, а никель-металлгидридные - экзотермичны, то есть при подзарядке они выделяют тепло. Как только они приближаются к состоянию полного заряда, их температура значительно увеличиваются. Соответственно, для каждого из этих типов аккумуляторов должны быть разработаны свои зарядные устройства.
Лучше всего подзаряжать никель-металлгидридные аккумуляторы с помощью специальных зарядных устройств. Тем не менее, они прекрасно выносят и непрерывную подзарядку малым током.
Литий - наиболее химически активный металл. На его основе работают современные источники питания для ноутбуков. Практически все высокоплотные источники питания используют литий в силу его химических свойств. Килограмм лития способен хранить 3860 ампер-часов. Для сравнения, показатель цинка - 820, а у свинца - и вовсе 260.
В зависимости от типа анода, литиевые элементы могут создавать напряжение от полутора до 3,6 вольт, что выше, чем у любых других элементов.
Проблема заключалась в том, что литий слишком активен. Он настолько бурно реагирует с водой, что может воспламениться. Коммерческое производство простых литиевых элементов началось в семидесятых. А уже в восьмидесятых некоторые компании стали серийно выпускать литиевые аккумуляторы. Такие батарейки быстро завоевали репутацию батареек с сомнительной безопасностью.
Для того чтобы решить эту проблему, создатели аккумуляторов пересмотрели технологию и стали использовать литий в ионном состоянии. Таким образом, был использован потенциал лития при приемлемом уровне безопасности. В таких элементах ионы лития находятся в активных веществах электродов, а не в металлических пластинах.
Обычно в таких элементах анод сделан из угля, а катод - из литийкобальтдиоксида. В качестве электролита обычно используется соляной раствор лития.
Литиевые батареи имеют большую плотность, нежели никель-металлгидридные. Такие элементы работают без подзарядки в ноутбуках в полтора раза дольше никель-металлгидридных. Кроме того, в литий-ионных элементах не наблюдаются эффекты памяти, которыми славились ранние никель-кадмиевые элементы.
С другой стороны, внутреннее сопротивление у современных литиевых элементов выше, чем у никель-кадмиевых. Соответственно, они не могут обеспечить больших токов. Если никель-кадмиевые элементы способны расплавить отвертку, то литиевые на это не способны, потому на их обечайках вы не найдёте предостережений. Но всё же, мощности в таких батарейках вполне хватит для обеспечения работы ноутбука без скачкообразных нагрузок (это значит, например, что определённые устройства, такие как жесткие диски, не должны вызывать высоких скачков нагрузки в определённых стадиях - например, при стадии раскрутки). Более того, даже не смотря на то, что литий-ионные батарейки выдерживают многократные подзарядки, такие батарейки живут меньше, чем те, в основе которых служит никель.
Так как в литий-ионных элементах используется жидкий электролит (пусть даже запакованный в тканевую прокладку), обычно они имеют форму цилиндра. Хотя такая форма ничуть не хуже форм других элементов, с появлением полимеризированных электролитов литий-ионные элементы приобретают более компактные формы
Наиболее перспективной из современных технологий считается доработка уже знакомых нам литиевых реакций и создание на их основе литий-твердополимерного элемента. В настоящее время большинство производителей аккумуляторов переключаются на эту технологию.
Тогда как в традиционных литий-ионных элементах используется жидкий электролит, в твердополимерных элементах электролит запечатан в полимерную пластиковую прокладку, находящуюся между электродами аккумулятора.
В качестве электролита такие элементы используют полимерные композиционные материалы (таких как полиакрилонитрил) с содержанием солей лития. Так как это вовсе не жидкость, а твердый материал, новые батарейки не требуют громоздких цилиндрических корпусов как у традиционных элементов. Вместо этого элементы производятся в форме плоских многогранников, которые легче умещаются в батарейные отсеки ноутбуков.
Производители с радостью используют эту способность и компенсируют относительно невысокую плотность таких элементов (сравнимую с обыкновенными литий-ионными) тем, что используют батарейные отсеки целиком (включая те пустоты, которые бы возникали при использовании цилиндрических элементов). При этом эффективность использования этого пространства повышается на 22 процента. Литий-твердополимерные элементы экологически чище и легче обычных, так как не имеют металлической оболочки. Кроме того, они безопаснее, так как не содержат легковоспламеняющихся растворителей.
В отличие от других литиевых элементов, где стремятся увеличить плотность, в этих элементах реализовано компромиссное решение. Они разработаны для стандартных устройств со стандартным напряжением в 1,5 В (традиционные литиевые аккумуляторы вырабатывают вдвое большее напряжение). Поэтому на них можно часто встретить надпись "voltage-compatible lithium" - совместимы по напряжению. В отличие от других литиевых технологий, литий-железодисульфидные элементы не подзаряжаются.
Внутренне такие элементы представляют собой слой литиевого анода, сепаратор, и железодисульфидный катод с алюминиевым катодным токосъемником. Эти элементы запечатаны, но имеют клапан для вентиляции.
По сравнению со щелочными элементами (также не подзаряжаемыми), литий-железодисульфидные элементы легче (их вес составляет 66% от веса щелочных), у них выше ёмкость и срок службы. Даже если взять такой элемент со склада после десяти лет хранения, он будет практически полностью заряжен.
Литий-железодисульфидные элементы легко выдерживают большие нагрузки. Они могут питать мощные устройства в 2,6 раза дольше щелочных элементов такого же размера. Но это преимущество незаметно при низких нагрузках. Например, при токе нагрузки в 20 мА, производители этих элементов размера AA указывают на них, что они проработают 122 часа, а производители щелочных - целых 135 часов. Совсем другую картину мы видим при увеличении тока нагрузки до 1 ампера - 2,1 часа против 0,8.
Такие батарейки можно использовать там же, где и углецинковые элементы. Но свою цену они оправдывают только при высоких токах нагрузки - в больших фонариках, в устройствах с моторчиками и в мощной электронике. Использовать же их для питания часов или карманных радиоприемников - по крайней мере, не разумно.
Эти элементы отличаются самой большой плотностью из всех современных технологий. Причиной тому стали компоненты, используемые в этих аккумуляторах. В качестве катодного реагента в этих элементах используется атмосферный кислород, что нашло отражение в их названии. Для того чтобы воздух реагировал с анодом из цинка, в корпусе батарейки проделаны небольшие отверстия. В качестве электролита в этих элементах используется гидроксид калия, обладающий высокой проводимостью.
Первоначально созданные как неподзаряжаемые источники питания, цинково-воздушные элементы характеризуется долгим и стабильным сроком хранения, по крайней мере, если хранить их герметично от воздуха, в неактивном состоянии. В этом случае за год хранения такие элементы теряют около 2 процентов емкости. Как только воздух попадает в батарею, эти батарейки живут не дольше месяца, независимо от того, будете вы их использовать, или нет.
Некоторые производители начали использовать ту же самую технологию в подзаряжаемых элементах. Лучше всего такие элементы зарекомендовали себя при продолжительной работе в маломощных устройствах. Основным же недостатком этих элементов является высокое внутреннее сопротивление, означающее, что для достижения высокой мощности, они должны быть огромного размера. А это означает необходимость создания в ноутбуках дополнительных отсеков для батареек, по размеру сопоставимых с самим компьютером.
Но следует отметить, что такое применение они начали получать совсем недавно. Первый такой продукт - совместное творение Hewlett-Packard Co. и AER Energy Resources Inc. - PowerSlice XL - показал несовершенство этой технологии при использовании в портативных компьютерах. Эта батарейка, созданная для ноутбука HP OmniBook 600 весила 3,3 кг - больше, чем сам компьютер. Работы же она обеспечивала всего 12 часов. Компания Energizer также стала использовать эту технологию в своих маленьких пуговичных батарейках, используемых в слуховых аппаратах.
Подзарядка батарей - тоже не такое простое дело. Химические процессы очень чувствительны к электрическому току, подаваемому на батарейку. Если подаваемое напряжение будет слишком низким, то батарейка будет отдавать ток, а не принимать. Если напряжение будет слишком высоким, могут начаться нежелательные реакции, способные испортить элемент. Например, при поднятии напряжения обязательно будет повышаться и сила тока, в результате батарейка перегреется. А если продолжать заряжать элемент уже после того, как он будет целиком заряжен, в нем могут начать выделяться взрывоопасные газы и даже наступить взрыв.
Современные устройства для подзарядки - это довольно сложные электронные приборы с различными степенями защиты - как вашей, так и ваших батареек. В большинстве случаев для каждого типа элементов существует своё собственное зарядное устройство. При неправильном использовании зарядного устройства можно испортить не только батарейки, но и само устройство, или даже системы, питаемые батарейками.
Существует два режима работы зарядных устройств - с постоянным напряжением и с постоянным током.
Самыми простыми являются устройства с постоянным напряжением. Они всегда производят одно и то же напряжение, и подают ток, зависящий от уровня заряда батарейки (и от других окружающих факторов). По мере зарядки батареи, ее напряжение увеличивается, поэтому уменьшается разница между потенциалами зарядного устройства и батареи. В результате по цепи протекает меньший ток.
Всё что нужно для такого устройства - трансформатор (для уменьшения напряжения зарядки до уровня, требуемого батарейкой) и выпрямитель (для выпрямления переменного тока в постоянный, используемый для заряда батареи). Такими простыми устройствами подзарядки пользуются для заряда автомобильных и корабельных аккумуляторов.
Как правило, подобными же устройствами заряжаются свинцовые батареи для источников бесперебойного питания. Кроме того, устройства с постоянным напряжением используются и для подзарядки литий-ионных элементов. Только там добавлены схемы для защиты батареек и их хозяев.
Второй вид зарядных устройств обеспечивает постоянную силу тока и изменяет напряжение для обеспечения требуемой величины тока. Как только напряжение достигает уровня полного заряда, зарядка прекращается. (Помните, напряжение, создаваемое элементом, падает по мере разряда). Обычно такими устройствами заряжают никель-кадмиевые и никель-металлгидридные элементы.
Кроме нужного уровня напряжения, зарядные устройства должны знать, сколько времени нужно подзаряжать элемент. Батарейку можно испортить, если слишком долго подзаряжать её. В зависимости от вида батареи и от "интеллекта" зарядного устройства для определения времени подзарядки используется несколько технологий.
В самых простых случаях для этого используется напряжение, вырабатываемое батарейкой. Зарядное устройство следит за напряжением батарейки и выключается в тот момент, когда напряжение в батарейке достигает порогового уровня. Но такая технология подходит далеко не для всех элементов. Например, для никель-кадмиевых она не приемлема. В этих элементах кривая разряда близка к прямой, и определить уровень порогового напряжения бывает очень сложно.
Более "изощренные" зарядные устройства определяет время подзарядки по температуре. То есть устройство следит за температурой элемента, и выключается, или уменьшает ток заряда, когда батарея начинает нагреваться (что означает избыточность заряда). Обычно в такие элементы питания встраиваются термометры, которые следят за температурой элемента и передают зарядному устройству соответствующий сигнал.
"Интеллектуальные" устройства используют оба этих метода. Они могут перейти с большого тока заряда на малый, или же могут поддерживать постоянный ток с помощью специальных датчиков напряжения и температуры.
Стандартные зарядные устройства дают меньший ток заряда, чем ток разряда элемента. А зарядные устройства с большим значением тока дают больший ток, чем номинальный ток разряда батарейки. Устройство для непрерывной подзарядки малым током используют настолько небольшой ток, что он разве что не даёт батарейке саморазрядиться (по определению такие устройства и используются для компенсации саморазрядки). Обычно ток заряда в таких устройствах составляет одну двадцатую, или одну тридцатую номинального тока разряда батарейки. Современные устройства зарядки часто могут работать на нескольких значениях токов заряда. Сначала они используют более высокие значения тока и постепенно переключаются на низкие, по мере приближения к полному заряду. Если используется батарейка, выдерживающая подзарядку малым током (никель-кадмиевые, например, не выдерживают), то в конце цикла подзарядки устройство переключится в этот режим. Большинство зарядных устройств для ноутбуков и сотовых телефонов разработаны так, что могут быть постоянно подключены к элементам и не причинять им вреда.
Зарядные устройства могут получить не так-то много информации о состоянии батарейки. Для оптимизации подзарядки и для увеличения срока службы батарейки, зарядные устройства должны знать степень заряда батарейки, о предыдущих подзарядках, должны знать температуру и другие физические параметры. Другими словами, зарядное устройство должно владеть всеми этими данными для обеспечения нормальной работы системы зарядное устройство-батарейка. То есть зарядное устройство и батарейка должны представлять собой единую систему.
Для обеспечения лучшей работы производитель батареек компания Duracell и компания Intel совместно разработали систему "умных" батареек (Smart Battery). Спецификация интеллектуальных батарей в первой версии (Smart Battery Data Specification, Version 1.0) вышла 15 февраля 1995 года. Она позволила упорядочить процессы заряда батареек с помощью добавления отслеживающей схемы в батареи и передачи стандартных сигналов на зарядное устройство.
Система Smart Battery определяет нескольких уровней, распределяющих взаимодействие между батареей, зарядным устройством и компьютерам. Кроме того, она обеспечивает недорогой канал связи между этими устройствами, называющийся системной шиной (System Management Bus). Но кроме физического соединения, спецификация определяет протокол обмена сообщениями и формат сообщений.
Спецификация интеллектуальных батареек определяет информацию о батарейке, которую она может передать зарядному устройству, равно как задает формат сообщений для ее передачи. В частности, зарядное устройство может получать информацию о химических процессах, о емкости, напряжении, и даже об упаковке батареи. Сообщения содержат не только информацию о текущем состоянии зарядки элемента, но также и историю всех предыдущих циклов подзарядки. Поэтому зарядное устройство может предсказывать срок службы элемента. Спецификация не зависит от используемых в элементе химических процессов и от устройства отслеживающей схемы. Единственное, что здесь должно четко соблюдаться - соединение с шиной и формат сообщений.
В дополнение был создан стандарт интеллектуального зарядного устройства (Smart Battery Charger specification), который кроме описания данных, передаваемых между зарядным устройством и батарейкой, ещё и определяет отношения между "интеллектуальными" батарейками и различными типами зарядных устройств. Кроме этого он описывает системную шину и соответствующий стандарт интерфейса для BIOS, который предоставляет управление системой программному обеспечению PC и операционной системе.
Практически все современные ноутбуки используют батареи, соответствующие этой спецификации, так как управление батареями входит в состав спецификаций ACPI (Advanced Configuration and Power Interface). Поддержка ACPI требуется для совместимости с последними версиями Windows. С помощью этого интерфейса производители компьютеров могут выбирать один из двух стандартов управления питанием: Smart Battery или недавно появившийся интерфейс управления батарей CMBatt (Control Method Battery Interface), описанный как часть стандарта ACPI. "Умная" батарея предоставляет аппаратный интерфейс (встроенный контроллер с регистрами), к которому операционная система компьютера может получить доступ через системную шину.
Интерфейс CMBatt добавляет язык управления более высокого уровня, называемый AML - ACPI Machine Language - это встроенный язык стандарта ACPI. Он позволяет управлять работой батареек (равно как питанием системы и ее конфигурацией) с помощью или без помощи встроенного контроллера. Производители батареек и компьютеров преобразуют свои инструкции по подзарядке батареек и по отслеживанию состояния заряда в код AML, который, в свою очередь, предоставляет информацию операционной системе компьютера. Использование языка AML даёт производителям широкие возможности- один и тот же код может управлять различными типами батарей и интерфейсами связи.
Чтобы продлить срок службы, их нужно эксплуатировать правильным образом. В случае неподзаряжаемых элементов, большое значение имеет способ хранения батареек. Если такой элемент правильно хранить в надлежащих условиях, он может всё это время целиком сохранять свой заряд. Относительно подзаряжаемых элементов, важно уметь правильно их подзаряжать.
Батарейки используют тщательно выверенные химические реакции. Как и любые другие химические реакции, они зависят от температуры. Высокие температуры не только повышают скорость реакций саморазряда, они могут стать причиной непроизвольных химических реакций внутри элемента, в результате которых могут произойти необратимые процессы и батарейка перестанет вырабатывать электричество. Например, если хранить углецинковые элементы при температуре 20 градусов, они портятся значительно быстрее. Поэтому их рекомендуется хранить при более низких температурах. От температур ниже 0 эти элементы не испортятся, но от слишком низких температур они лучше работать не станут.
Щелочные элементы хранятся лучше, чем стандартные углецинковые. При меньших температурах срок годности этих элементов увеличивается, но хранить элементы при низких температурах (ниже 20 градусов) не эффективно с экономической точки зрения. Если же хранить щелочные элементы при температуре выше 20 градусов - срок хранения будет меньше. Чем выше температура хранения, тем быстрее портятся батарейки.
Срок годности литий-дисульфидных элементов довольно большой (10 лет) даже при комнатной температуре. Но если температура хранения будет выше, срок их годности значительно сократится.
Все подзаряжаемые элементы питания плохо переносят перегрев. Не важно, был он вызван плохими условиями хранения, или неправильным подзарядом. Сильный перегрев в результате неправильной подзарядки может испортить практически любой аккумулятор. Большинство элементов при подзарядке нагреваются. Если же заряжать слишком долго, о них можно обжечься. Обычно такой сильный перегрев возникает из-за неисправностей зарядного устройства или при попытке подзарядить не разряженную батарею допотопным зарядным устройством.
Ни один аккумулятор не разряжается полностью - разве что при коротком замыкании электродов. Некоторые элементы, если разрядить их сильнее положенного, могут поменять полярность. Поэтому если устройство предупреждает вас, что батарейка села, и выключается - не пытайтесь продолжать разряжать элемент.
Многие подзаряжаемые элементы, в особенности никель-кадмиевые, лучше всего хранятся в разряженном состоянии. Поэтому батарейки в новых устройствах, как правило, не заряжены. На склады ноутбуки попадают с незаряженными аккумуляторами. В розничных же магазинах они, скорее всего, заряжаются непосредственно перед тем, как попасть на прилавок.
Чтобы нейтрализовать эффект памяти, никель-кадмиевые элементы лучше использовать по возможности целиком и до конца разряжать перед подзарядкой. Например, чтобы во время бизнес-тура использовать всю емкость никель-кадмиевых элементов, необходимо непосредственно перед поездкой полностью их разрядить.
Литий-ионные элементы, в отличие от никель-кадмиевых, не обладают эффектом памяти. А так как они выдерживают меньшее количество циклов разряда, перед поездкой лучше подзаряжать их не разряжая.
Лучше всего с задачей выбора оптимального элемента для конкретного устройства справляются инженеры. Это их хлеб. У каждого устройства свои требования к элементам питания.
В ряде случаев право выбора остаётся за вами. Например, в некоторых компьютерах могут нормально работать батарейки разных типов. К примеру, в периферийных устройствах выбор батарейки ограничен только размерами. В разных случаях правильный выбор элемента может зависеть от многих факторов - начиная химическими процессами заканчивая торговой маркой.
Современные ноутбуки очень противоречивы в требованиях к элементам питания. Во-первых, им нужна максимальная емкость. Во-вторых, ноутбуки требовательны к размерам и весу аккумуляторов. Выполнить всё это разом не является возможным, поэтому, как правило, приходится выбирать компромиссное решение.
Большинство ноутбуков использует один из трех популярных типов подзаряжаемых батареек - никель-кадмиевые, никель-металлгидридные или литий-ионные. Производителей таких аккумуляторов не так и много. При выборе же в основном руководствуются соотношением времени работы и цены. Никель-кадмиевые элементы, как правило, наиболее дешевые, но и энергии они вырабатывают меньше. Литий-ионные батарейки могут работать вдвое дольше, но стоят на 50-75 процентов дороже. Никель-металлгидридные считаются золотой серединой.
Как правило, выбирать приходится из того, что предлагает производитель компьютеров - ведь именно он разрабатывает дизайн отсека для батареек. Производители могут создавать такие отсеки индивидуально для каждой модели ноутбука. Хотя разработка такого персонального отсека имеет свои преимущества - например, такое решение позволяет производителю ноутбука оптимальным образом использовать имеющееся в компьютере место - это сковывает потребителя в выборе батареек. Обычно стоимость таких батареек крайне велика.
Заметьте, большинство ноутбуков использует аккумуляторы стандартных размеров. Производители компьютеров покупают аккумуляторы точно так же, как и вы. Поэтому вы можете открыть батарейный отсек и поменять аккумулятор на новый. Но, как правило, в этом случае вы теряете гарантию как на батарейку, так и на ноутбук.
Уровни продаж наиболее популярных ноутбуков достаточно высоки, так что совместимые источники питания от сторонних производителей также находят свой спрос. Из этого вы можете извлечь свою выгоду. Но учтите, что химические процессы накладывают свои ограничения на зарядные устройства, и если вы захотите использовать более мощные элементы на другой химии, удостоверьтесь, что ваше зарядное устройство сможет подзарядить такие элементы. Не стоит рисковать и ставить в ноутбук элементы питания, не рекомендованные производителем компьютера.
Для того чтобы компьютер не забывал время в момент выключения, в большинстве систем имеются маленькие встроенные батарейки. Каждый производитель компьютеров по-своему смотрит на эти батарейки. Наиболее часто используются заменяемые кнопочные элементы, в основе которых - литий, и второй вариант - интегрированные модули со встроенными элементами.
Обычно на материнской плате можно встретить литиевые батарейки. Присмотритесь и заметите крошечные металлические кругляши. В большинстве гнезд батарейки придерживает металлическая защелка, одновременно выступающая в качестве контакта на аноде. Чтобы заменить батарейку, можно высвободить её из гнезда с помощью отвертки. На её место нужно вставить новую, только удостоверьтесь, что она плотно попала на своё место.
Что касается модулей, то чаще всего встречаются интегрированные модули от Dallas Semiconductor. Некоторые производители, чтобы сделать их заменяемыми, устанавливают их в гнезда. Но в большинстве случаев эти модули припаяны к плате. Теоретически, литиевые элементы, используемые в модуле, должны непрерывно проработать в течение десяти лет, и предполагается, что компьютер дольше не живет. Поэтому, теоретически, вам не придется их менять.
Когда такая батарейка садится, компьютер, как правило, сам предложит вам её поменять. Если ваш компьютер регулярно забывает название диска, или каждый раз у вас неправильное время, скорее всего, наступил момент поменять батарейку.
Так как вес в таких устройствах роли не играет (в отличие от цены), то чаще всего используются свинцовые аккумуляторы. Чтобы обеспечить максимальное удобство в обслуживании таких устройств, в большинстве систем бесперебойного питания применяется желеобразный электролит.
Зарядные устройства в этих системах достаточно сложны и превосходно выполняют свою работу подзаряжая (свинцовые аккумуляторы от непрерывной подзарядки малым током даже восстанавливаются) и предохраняя их от полного разряда. Лучшие системы бесперебойного питания периодически проверяют аккумуляторы, хватит ли их емкости для обеспечения работы на определенное время.
Если вы пользуетесь источником бесперебойного питания, помните, что срок службы аккумулятора в нем ограничен. Через несколько лет желеобразный электролит уже не сможет обеспечить работы устройства даже на короткое время.
Если не проверять периодически работоспособность аккумулятора, то незаметный выход их из строя может оказаться большим сюрпризом для вас - источник бесперебойного питания проработает не дольше нескольких секунд и тут же выключится. Проблема заключается в том, что элементы с желеобразным электролитом способны удерживать заряд всё время срока службы. Тем не менее, после трёх-пяти лет службы, они могут внезапно дать о себе знать - батарея может выти из строя уже через несколько недель после первого ухудшения. Неделю устройство ещё как-то проработает, а на следующую - откажет.
Заметим, что такие аккумуляторы изнашиваются в независимости от того, активно ими пользовались, или нет. Они портятся даже если их не использовать вовсе. Хотя при повторяющихся сильных нагрузках срок их службы укорачивается быстрее.
Чтобы предотвратить такого рода неприятности, в хороших системах обеспечения бесперебойного питания автоматические механизмы периодически проверяют емкость аккумулятора. Не следует пренебрегать сигналом о неисправности батареи. Следует немедленно её заменить.
Заметим, что основную долю в стоимости таких систем составляет стоимость непосредственно аккумулятора. Если же вы захотите купить аккумулятор, чтобы заменить испортившийся, он обойдётся вам ещё дороже.
В некоторых случаях бывает дешевле купить новую систему бесперебойного питания, чем поменять аккумуляторы в старом - особенно когда эту работу выполняют квалифицированные мастера. В больших и более дорогих устройствах, как правило, предусмотрены детали, облегчающие процесс замены аккумулятора. Например, в некоторых устройствах предусмотрен выдвижной отсек.
В большинстве таких устройств используются батарейки стандартных размеров. Это позволяет вам найти оптимальное с экономической стороны решение.
Отметка "heavy-duty" на углецинковых элементах это не пускание пыли в глаза. Таким способом помечают батарейки, используемые в фонариках и игрушках с моторчиками. В подобных приложениях с высоким потреблением электроэнергии такие элементы по сроку службы значительно превосходят обыкновенные. Когда же потребности в высоких токах не возникает (например, в настенных часах), преимущество таких элементов незначительно. И с экономической точки зрения традиционные элементы могут оказаться значительнее эффективнее. То же самое относится и к элементам с отметкой "super heavy-duty".
Всё вышеизложенное не относится к литиевым элементам. Для устройств, потребляющих высокие токи, лучше использовать совместимые по напряжению (1,5 В) литий-сульфидные элементы. Но в маломощных устройствах, они работают хуже, чем батарейки других типов. Их размеры не отличаются от обычных щелочных элементов. Впрочем, некоторые типы литиевых элементов превосходно работают и в маломощных устройствах, например, в компьютерах используются кнопочные литиевые элементы напряжением в 3 Вольта.
В устройствах, где тип элементов не важен (подзаряжаемый или одноразовый), если устройства должны работать много и долго, лучше использовать подзаряжаемые элементы. Несмотря на то, что они и стоят в 5-10 раз дороже обыкновенных элементов, их можно подзаряжать сотни раз. Хотя в старых подзаряжаемых элементах емкость и меньше, чем в неподзаряжаемых, современные никель-металлгидридные элементы таким недостатком не обладают.
Тем не менее, подзаряжаемые элементы не стоит использовать в маломощных или в редко работающих устройствах. Высокая скорость саморазряда большинства подзаряжаемых элементов делает их малоудобными (скорее всего, вам придется подзаряжать их каждую неделю, в независимости от того, пользовались вы ими, или нет). Редко работающие устройства, например фонарики, требуют элементов, скорость саморазряда которых невысока - чтобы не случилось так, что в нужный момент в аккумуляторах не осталось энергии.
Каждый производитель при производстве элементов проводит свои экспертизы. Отличия в элементах различных марок едва уловимы, но они могут играть важную роль в определенных приложениях. Например, производитель цифровых фотоаппаратов может порекомендовать пользоваться только определенным типом щелочных элементов. Журнал PC Magazine проводил своё исследование работы различных типов щелочных элементов на различных фотоаппаратах. Тесты показали огромную разницу в количестве снимков. Если сомневаетесь, сравните срок службы элементов различных марок в таких устройствах.
Внутреннее сопротивление ограничивает ток, производимый батарейкой. Сопротивление углецинковых элементов сравнительно велико, поэтому эти элементы могут вырабатывать довольно невысокие токи - порядка нескольких сот миллиампер. Свинцовые, никель-кадмиевые, и никель-металлгидридные элементы обладают невысоким внутренним сопротивлением и могут вырабатывать токи огромной величины.
Если замкнуть электроды таких батарей - то предмет, которым вы произведёте это замыкание (провод, полоска металла, монета в кармане), станет нагреваться вследствие своего сопротивления. Например, если замкнуть электроды заряженного автомобильного аккумулятора гаечным ключом, вы можете его расплавить. Если же по неосторожности замкнуть электроды никель-кадмиевого аккумулятора для ноутбука, можно устроить пожар. Будьте осторожны при обращении с аккумуляторами и не замыкайте их.
Практически во всех подзаряжаемых элементах при чрезмерной подзарядке из-за электролиза вырабатывается водород. В герметичных элементах, используемых в современных компьютерах и сотовых телефонах, возможность воспламенения и взрыва водорода сведена к минимуму. Но такой шанс, хотя и небольшой, все ещё есть. Во всех таких аккумуляторах предусмотрены вентиляционные клапаны, которые открываются под сильным давлением, возникающим внутри элемента в результате электролиза. Шанс, что выходящий водород загорится, невелик. Тем менее вероятно, что произойдёт взрыв.
Намного опаснее закупорить эти вентиляционные отверстия - в результате давление внутри элемента будет повышаться, что может привести к взрыву элемента даже без загорания газа. Никогда не затыкайте вентиляционные отверстия в подзаряжаемых элементах.
Обычные элементы, как правило, герметичны. При сильном нагревании используемые внутри материалы могут испортиться и даже закипеть. Внутри элемента может образоваться давление, достаточное для взрыва. При попытке заряда неподзаряжаемого элемента, как и при его сжигании, может случиться взрыв.
Практически во всех батарейках в той или иной степени содержатся вредные вещества. Свинец и кадмий являются токсичными металлами. Литий быстро вступает в химические реакции. Чистый литий, к примеру, может самопроизвольно вступать в реакцию с атмосферным кислородом и самовоспламениться. А при попытке потушить такой огонь, литий может вступать в реакцию и с водой. Хотя ртуть уже не используется в большинстве элементов, даже марганец, применяемый в углецинковых элементах, считается опасным.
Все батарейки, так или иначе, представляют экологическую опасность. Поэтому старайтесь их правильно эксплуатировать. Некоторые производители начинают создавать средства по переработке использованных батареек. Не забывайте об экологии, пользуйтесь теми батарейками, которые можно отдать на вторичную переработку.