
|
Опрос
|
реклама
Быстрый переход
Инженер создал 10-граммовую робо-птицу, которая разгоняется до 31 км/ч и управляется со смартфона
18.02.2026 [15:44],
Геннадий Детинич
Французский инженер Эдвин Ван Рюмбеке (Edwin Van Ruymbeke) представил дрон-орнитоптер «Стриж» (Swift). Этот небольшой дрон имитирует полёт настоящих птиц, в частности стрижа, за счёт активных маховых движений крыльями для создания подъёмной силы. Управление осуществляется через мобильное приложение под iOS или Android, а сама модель позиционируется как наиболее развитый и универсальный орнитоптер из тех, которые можно купить по разумной цене. 
Источник изображений: Edwin Van Ruymbeke В настоящий момент проект «Стриж» находился на завершающей стадии разработки и подготовки к производству для частных заказов. Главное техническое новшество «птички» заключается в использовании двух сменных хвостов: скоростного (Speed tail) для полёта на высокой скорости и точного (Precision tail) для медленного и стабильного маневрирования. Благодаря этому орнитоптер способен развивать скорость до 31 км/ч на открытом воздухе и снижать её до 3,5 км/ч, что позволяет уверенно летать даже в помещениях. Робо-птица весит всего 10,9 грамма, выполнена из лёгкого вспененного полипропилена, углеродных стержней и титана, что обеспечивает высокую прочность и устойчивость к авариям. Время полёта от одной зарядки составляет 10–12 минут, а дальность управления достигает 150 метров.  Управление орнитоптером максимально интуитивно: приложение предлагает пять предустановок для каждого хвоста, регулирующих скорость, планирование и отзывчивость, а встроенная инерциальная система в реальном времени корректирует полёт и помогает стабилизировать аппарат даже новичкам. Дополнительно доступен опциональный аксессуар X-Play — ёмкостный джойстик, надеваемый на смартфон и превращающий его в классический пульт. Запуск возможен как с руки, так и с земли благодаря небольшим колёсикам на корпусе. «Стриж» выделяется на фоне большинства других орнитоптеров, которые обычно ограничены одной «крейсерской» скоростью и требуют больших открытых пространств. Благодаря сменным хвостам и продвинутой электронике он сочетает высокую динамику полёта на улице с возможностью точного управления в ограниченном пространстве. Это делает его интересным не только для любителей, но и важным как демонстрация прогресса в области копирующих природу летательных аппаратов малого класса. На момент написания статьи розничная цена устройства планируется на уровне €156, а благодаря взносу на площадке Kickstarter можно уложиться в €109. Первые поставки запланированы на сентябрь этого года. В Китае создали «глаз мухи» для дронов с панорамным зрением и встроенным «обонянием»
13.02.2026 [22:00],
Геннадий Детинич
Исследователи пока не смогли создать сферические мушиные глаза, но даже упрощённый глаз на плоской подложке впечатляет миниатюрными размерами и возможностями. Это платформа размером всего 1,5 × 1,5 мм. По сути, это габариты насекомого, что приближает появление миниатюрных дронов размером с таракана или даже муху. Современные устройства машинного зрения намного крупнее, сложнее и требуют значительной энергии и вычислительных ресурсов, от чего китайская разработка ушла довольно далеко. 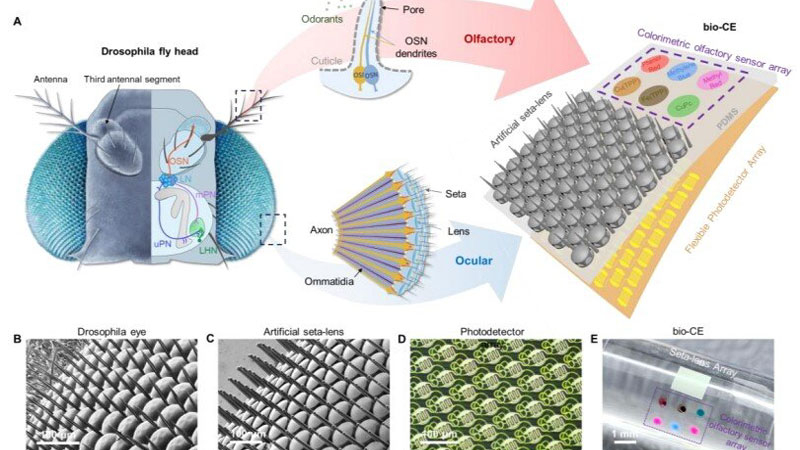
Источник изображения: Nature Communications 2026 Более того, этот миниатюрный датчик содержит сенсоры ряда опасных газов, которые искусственный глаз распознаёт автоматически. Даже мухи на такое не способны — их глаза лишены обоняния. Комбинация зрения и обоняния на одном компактном сенсоре — это шаг на пути повышения энергоэффективности миниатюрных роботизированных платформ, а также увеличения скорости их реагирования на окружающую обстановку. Отвечающая за зрение часть датчика состоит из 1027 элементов с микролинзами, напечатанными непосредственно на гибком фотодетекторе с помощью фемтосекундной лазерной двухфотонной полимеризации (FL-TPP). Это делает каждый оптический элемент изолированным от других, обеспечивая поле зрения шириной 180°. Слияние вспышек света для датчика начинается с частоты выше 1 кГц — это почти на два порядка больше, чем у человеческого глаза. Тем самым искусственный мушиный глаз различает намного более быстрые движения. Обонятельная компонента реализована методом струйной печати на той же платформе: массив колориметрических сенсоров меняет цвет при контакте с опасными газами и химикатами, имитируя «нюх» насекомого. Дополнительно между линзами добавлены щетинки, как у настоящих насекомых, что необходимо для защиты от запотевания во влажной среде. Щетинки удержат капельки влаги на себе и не дадут им затянуть линзы. В тестах датчика на миниатюрном четырёхколёсном роботе система продемонстрировала высокую чувствительность при сближении с препятствиями и движущимися помехами без необходимости поворота «головы» благодаря панорамному обзору. Робот одновременно обнаруживал препятствия слева и справа, а также реагировал на утечки опасных газов. Устройство показало отличную производительность в обнаружении быстрых движений и химических угроз, превзойдя многие существующие сенсоры по компактности и энергоэффективности. Разработка открывает новые возможности для навигации беспилотных платформ, включая микродроны и рои роботов, в сложных условиях — например, при поиске выживших в завалах или мониторинге химических утечек в зонах катастроф. Такой датчик может значительно повысить «интеллект» биороботов за счёт одновременного визуально-обонятельного восприятия при минимальной массе и энергозатратах, обеспечивая важный шаг в направлении автономных систем следующего поколения. Биоинженеры впервые встроили квантовый механизм в природный белок
30.01.2026 [14:14],
Геннадий Детинич
Биологам давно известны квантовые механизмы в природных белках и живых организмах, например, явление флуоресценции и биомагнитная ориентация птиц и насекомых. Природа в этом опередила человека. Но учёные воспользовались эволюционным методом для искусственного отбора белков с нужными им свойствами и впервые целенаправленно получили природный белок со встроенным квантовым механизмом. 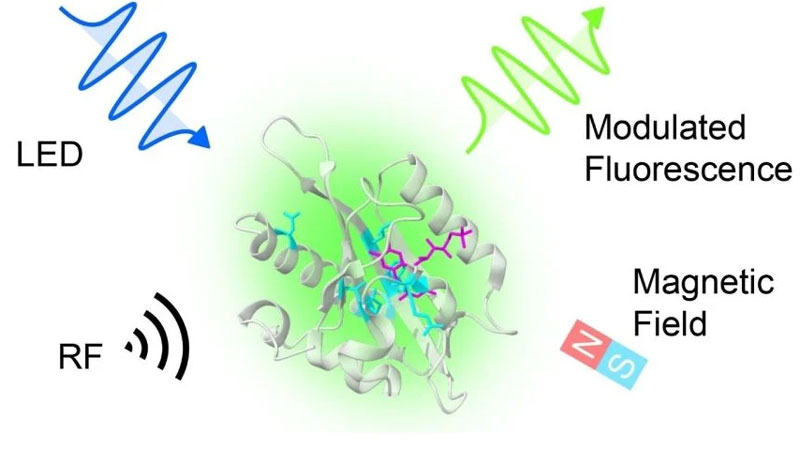
Источник изображения: University of Oxford Проделанная работа может считаться одним из первых в Великобритании междисциплинарных исследований, в котором приняли участие специалисты по ИИ, биологии и квантовым наукам. Это триада, которая становится остриём современного развития науки и техники во всём мире. Неудивительно, что на стыке этих дисциплин произошёл прорыв, если так можно сказать, в постквантовый киберпанк. Белки с квантовыми устройствами — это возможность наделить человека чем-то таким, что до этого представлялось настоящей фантастикой. Учёные из Университета Оксфорда (University of Oxford) целенаправленно контролировали процесс мутации одного из белков овсянки до наделения его требуемыми свойствами. В данном случае исследователи добивались чувствительности белка к микроволновому излучению. Тем самым были разработаны так называемые магниточувствительные флуоресцентные белки (MFPs), способные взаимодействовать с магнитными полями и радиоволнами при возбуждении белка светом определённой длины волны. Безусловно, подобное открывает совершенно новый класс биотехнологий, основанных на квантовых эффектах, а не только на классической биофизике или химии. Механизм работы квантового белкового комплекса следующий: магниточувствительные флуоресцентные белки возбуждаются светом синего светодиода. Сами по себе они излучают флуоресцентный свет другого цвета (зелёный). Интенсивность этой флуоресценции можно регулировать, применяя магнитные или радиочастотные поля соответствующей мощности и частоты. Внутри белка существует электронная система, способная поддерживать квантовые состояния спина или другие квантовые явления, на которые непосредственно воздействует микроволновое излучение. Тем самым белок имеет встроенный квантовый механизм, которым учёные могут управлять по своему желанию. Одним из перспективных направлений применения таких белков является молекулярная визуализация внутри живых организмов. Исследователи уже создали прототип прибора, который с помощью принципов, схожих с магнитно-резонансной томографией (МРТ), способен обнаруживать эти белки в ткани. Однако, в отличие от традиционной МРТ, новая технология потенциально сможет отслеживать конкретные молекулы или экспрессию генов, что критично для задач целевой доставки лекарств и мониторинга генетических изменений, например в опухолях. Слепому человеку впервые вернули зрение с помощью напечатанной на 3D-принтера роговицей
02.12.2025 [19:00],
Геннадий Детинич
В конце октября 2025 года в Институте глаза Рамбам (Rambam Eye Institute) в Израиле впервые в мире была успешно проведена трансплантация полностью 3D-печатной роговицы, которая вернула зрение слепому пациенту. Роговица напечатана в несколько слоёв из клеток донора в полном соответствии с естественной структурой этой части глаза человека. 
Источник изображений: Precise Bio Имплантат создан американско-израильской компанией Precise Bio по технологии, основанной на разработках британского Университета Ньюкасла (Newcastle University). Роговица может повреждаться инфекцией, генетически или от травмы, лишая человека зрения. Донорская ткань хорошо приживается, но её запасов в большинстве стран обычно нет. Предложенная учёными технология позволяет напечатать 300 роговиц из клеток одной роговицы донора, решая проблему нехватки донорской ткани. 
Принтер напечатал роговицу толщиной 500-600 мкм с разрешением в мкм и с заданной кривизной Технология использует высокоточный 3D-биопринтер, который послойно формирует пространственную структуру роговицы (эпителий, строма, эндотелий) из слоёв коллагенового геля с культивированными клетками. После печати имплантат «дозревает» в биореакторе, приобретая естественную прозрачность и механические свойства. Благодаря полной биосовместимости отторжения практически не происходит, а иммуносупрессия не требуется. Процедура заняла стандартное время — от часа до двух, а восстановление зрения у пациента произошло в течение нескольких недель без осложнений. Успешная операция открывает путь к массовому производству роговиц и, в перспективе, других органов (сердца, печени, почек). В отличие от традиционной трансплантации, зависящей от доноров (которых катастрофически не хватает), новая технология обещает ликвидировать очереди, по крайней мере в офтальмологии. Это событие признано одним из главных медицинских прорывов 2025 года и даёт надежду миллионам людей, страдающих от слепоты из-за повреждения роговицы. Грибная электроника приближается — учёные превратили мицелий шиитаке в нейронную сеть
28.10.2025 [12:26],
Геннадий Детинич
В последние годы учёные активно исследуют возможность использования в электронике грибного мицелия как естественной нейронной сети. С его помощью электроника может стать биоразлагаемой и энергоэффективной, создав основу для высокопроизводительных вычислений будущего, где обычная компостная куча сможет стать элементом кластера. 
Источник изображения: The Ohio State University / John LaRocco Традиционные полупроводники на всех этапах обработки требуют огромных энергозатрат и наносят вред окружающей среде, тогда как грибные структуры предлагают экологически чистый и менее затратный с точки зрения потребления энергии подход к обработке и хранению данных. В новом исследовании учёные из Университета штата Огайо (The Ohio State University) предприняли попытку создать на основе обычных съедобных грибов органические мемристоры — компоненты, имитирующие нейронную активность мозга. Подобная технология открывает путь к биоэлектронике, где грибные сети выступают в роли стабильных и недорогих элементов вычислительных платформ. В ходе работы, результаты которой были опубликованы в журнале PLOS ONE, исследователи культивировали образцы мицелия шиитаке и шампиньонов, после чего высушили их для лучшей сохранности и подключили к электронным цепям. Для тестирования применялись различные напряжения и частоты: в мицелий помещались электроды, а съём данных производился в разных точках структуры. Таким образом, учёные «обучали» сеть мицелия работать подобно мемристору — элементу памяти, который сохраняет информацию о предыдущих электрических состояниях. В ходе экспериментов было обнаружено, что некоторые участки мицелия воспроизводят эффекты памяти, аналогичные работе полупроводниковых чипов. В частности, удалось добиться скорости переключения электрического состояния мицелия с частотой 5850 Гц и точностью 90 %. По мере увеличения частоты эффективность работы памяти из мицелия снижалась, однако этот барьер можно преодолеть за счёт расширения сети (и параллельной работы множества элементов памяти) — что для грибного мицелия труда не составит. В режиме ожидания, как нетрудно догадаться, мицелий не требовал энергии для поддержания состояний. Получив столь интересный результат, учёные уже мечтают о носимых гаджетах с грибным мицелием в качестве нейронной сети и о создании огромных ферм для масштабирования вычислений в интересах аэрокосмической отрасли или супервычислений — с минимальными затратами энергии и возможностью полной утилизации «грибных» компьютеров. Почему были выбраны грибы шиитаке? Возможно, это реверанс в сторону спонсора работы — Исследовательского института Honda. Учёные сделали экологичный аккумулятор на витамине B2
16.10.2025 [11:22],
Геннадий Детинич
Прогресс в развитии аккумуляторов движется по разным направлениям, включая поиск биоразлагаемых и безопасных для природы и человека ингредиентов батарей. Новым и перспективным открытием на этом пути стала разработка проточной батареи на основе процессов, имитирующих выработку энергии в теле человека. Более безопасную технологию просто трудно представить — основными составляющими процесса являются витамин B2 и глюкоза. 
Источник изображения: ИИ-генерация Grok 3/3DNews Витамин и ложка сахара буквально могут стать основой для нового поколения экологически чистых аккумуляторов. Об открытии в журнале ACS Energy Letters сообщили исследователи Бингемтонского университета в США (Binghamton University, SUNY). Разработка не использует металлические катализаторы и опасные соединения для электродов и электролита. Окисление глюкозы высвобождает электроны, а переносчиком зарядов выступает рибофлавин — обычный витамин B2. Примерно такие процессы происходят в организме человека, когда глюкоза из пищи с помощью ферментов и молекул превращается в энергию для поддержания жизни, а рибофлавин является её фактическим переносчиком. Проточные аккумуляторы отличаются от обычных тем, что в них энергия накапливается в жидком электролите, который циркулирует по системе. Когда электролит перемещается между положительным и отрицательным электродами, он вступает в химические реакции, в результате которых энергия высвобождается или накапливается. Сегодня наиболее распространены ванадиевые проточные батареи. Прототип проточной батареи на витамине и глюкозе при комнатной температуре показал себя не хуже коммерческой ванадиевой, что подчёркивает хорошие перспективы разработки. 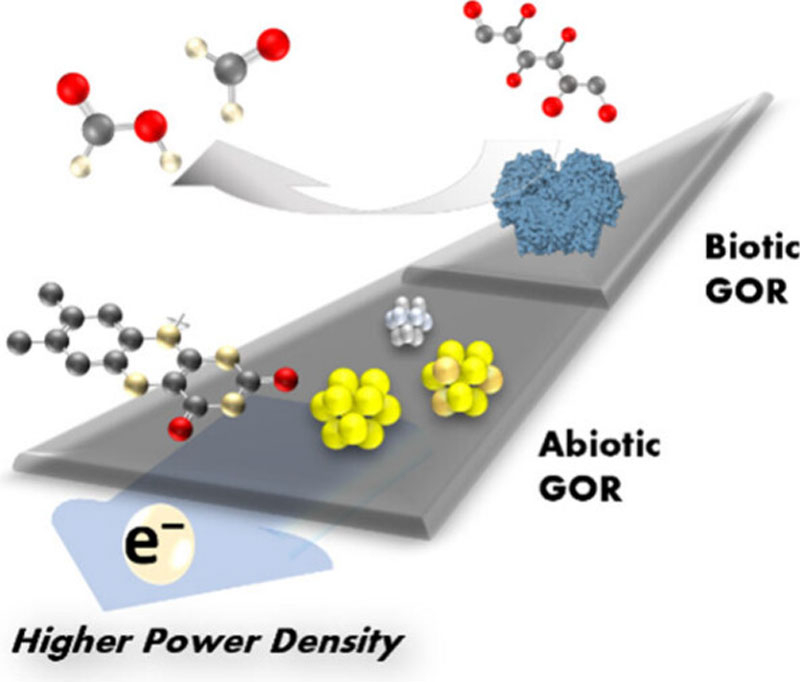 Более того, в новой конструкции биоразлагаемого аккумулятора традиционные катализаторы из золота и платины заменены углеродными электродами. У отрицательного электрода глюкоза окислялась, теряя электроны, которые тут же подхватывал витамин B2, а у положительного электроны вступали в связь благодаря кислороду либо феррицианиду калия, создавая ток. При этом витамин рибофлавин оставался стабильным даже в сильно подщелоченной среде, необходимой для поддержания активности глюкозы. Элемент на основе феррицианида калия показал такую же удельную мощность при комнатной температуре, как и коммерческие ванадиевые проточные батареи. Это доказывает, что рибофлавин может работать наравне с системами на основе металлов. Версия на основе кислорода реагировала медленнее, но была более практичной и экономичной для крупномасштабного производства. Небольшой проблемой стало разрушение рибофлавина на свету в присутствии кислорода, но это решаемо. Привлекательной остаётся более высокая удельная мощность батареи в присутствии кислорода. 
Напечатанный на 3D-принтере прототипе батареи на витамине и глюкозе. Источник изображения: Binghamton University После доработки аккумуляторная система на основе рибофлавина и глюкозы может стать важным шагом на пути к устойчивому хранению энергии. Благодаря натуральным, биоразлагаемым и недорогим компонентам такие аккумуляторы однажды могут стать экологичной альтернативой для питания домов или небольших устройств без использования токсичных металлов и зависимости от сложных цепочек поставок. У мозга появился конкурент — ДНК-компьютер с невероятно доступным источником питания
02.10.2025 [22:17],
Геннадий Детинич
Практически все вдохновленные биологией разного рода молекулярные компьютеры сталкиваются с фундаментальной проблемой: отсутствием универсального источника энергии, подобного электричеству в компьютерах или АТФ в живых организмах. Это делает их одноразовыми, ограничивая выполнение задач до исчерпания «топлива». Учёные из США разработали ДНК-компьютер с невероятно доступным источником питания — это обычное тепло, которое можно найти везде. 
Источник изображения: ИИ-генерация Grok 3/3DNews Об открытии статьёй в журнале Nature сообщили исследователи Тяньци Сонг (Tianqi Song) и Лулу Цянь (Lulu Qian) из Калифорнийского технологического института (Caltech). Они разработали многослойные логические схемы и нейронные сети на основе ДНК, которые можно многократно перезаряжать простым циклом нагрева и охлаждения. Такой подход позволяет системам работать минимум 16 циклов без накопления отходов, открывая путь к автономным молекулярным вычислениям. У мозга появился конкурент: органика оказалась способной к сложным «раздумьям» на иных принципах без использования нервных тканей. Учёные нашли выход в том, что назвали кинетической ловушкой. Это стало механизмом перезарядки ДНК-компьютера. «Это как взведённая мышеловка», — поясняют исследователи. Она готова к действию от малейшего прикосновения. Нити ДНК специально спроектированы так, чтобы сгибаться в форму шпильки-невидимки для волос. При нагреве до 95 °C все нити разделяются и свободно плавают в растворе. При охлаждении они быстро формируют шпильки — одномолекулярные структуры. Эта шпилька остаётся заряженной — готовой к действию — до появления в растворе входных данных в виде молекул-катализаторов. Катализаторы высвобождают энергию в процессе распрямления молекул ДНК. В зависимости от входных данных, зашифрованных в молекулах-катализаторах, происходит вычислительный процесс — реакции молекул ДНК. Чтобы вернуть схему в первоначальное состояние, необходимо нагреть раствор и затем охладить его: молекулы ДНК снова распрямляются, а потом сворачиваются в форму шпилек. Такой простой цикл обеспечивает полную перезагрузку схемы за считаные минуты — без внесения химикатов и иной подпитки. Для эксперимента исследователи создали полноценную 100-битную нейронную сеть, способную классифицировать рукописные цифры «6» и «7» из базы данных MNIST. Система включала до 289 различных нитей ДНК в одной пробирке и использовала чередующиеся слои вентилей из «шпилек». Такая архитектура обеспечила бесперебойную передачу сигналов через несколько уровней, минимизируя помехи и повышая масштабируемость. Вычисления происходили без чипов или электричества, полагаясь исключительно на молекулярные взаимодействия, что наглядно продемонстрировало потенциал ДНК для решения сложных задач машинного обучения. 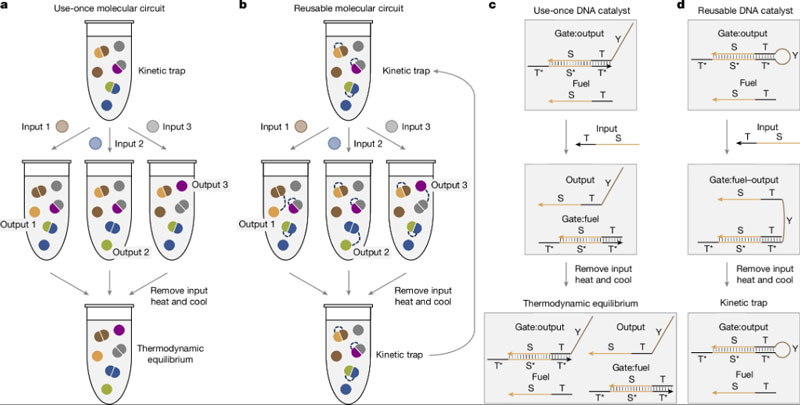
Источник изображения: Nature 2025 После отработки алгоритма раствор с ДНК перезагружается: добавляются молекулы-ингибиторы для нейтрализации входных данных (молекул-катализаторов), затем следует нагрев для разделения нитей и охлаждение для нового формирования шпилек. Этот процесс был повторён для десяти тестовых изображений, подтвердив надёжность системы в обработке разнообразных данных. Отсутствие накопления отходов и стабильность на протяжении 16 циклов подчеркнули практическую жизнеспособность подхода и преодоление прежних ограничений ДНК-вычислений, где логические элементы быстро деградировали из-за побочных продуктов. Прорыв радикально расширяет понятие компьютера, показывая, что устойчивые вычисления возможны без проводов или кремния — достаточно простых изменений температуры. Он закладывает основу для автономных химических систем с вычислениями и обучением без контроля, во многом имитируя эволюцию жизни. Это также обостряет вопросы о природе интеллекта, противопоставляя наш эволюционировавший мозг «мышлению» в молекулярных нейронных сетях. Белок живой клетки впервые превратили в кубит — это сулит квантовые вычисления при комнатной температуре
21.08.2025 [20:28],
Геннадий Детинич
Пока учёные спорили о вероятной квантовой природе человеческого мышления, исследователи из Притцкеровской школы молекулярной инженерии Чикагского университета (UChicago PME) сделали удивительное открытие — превратили белок из живой клетки в полноценный кубит. При этом не нужно никаких сверхнизких температур — белок демонстрирует квантовые свойства при комнатной температуре в составе живого организма. 
Источник изображения: ИИ-генерация Grok 3/3DNews «Мы вступаем в эпоху, когда граница между квантовой физикой и биологией начинает стираться. Именно здесь произойдёт прорыв в науке», — высказал своё мнение один из учёных, не принимавший участия в экспериментах. На самом деле биологические процессы по своей сути вполне квантовые — как, впрочем, и вся физика и химия во Вселенной. Другое дело, что обнаружить и использовать квантовые свойства элементарных частиц или макроструктур — это сложная задача для современной науки. До сих пор учёные могли проделать это только в чрезвычайно защищённых условиях и при сверхнизких температурах. Не потому, что иначе невозможно, а потому, что так проще. Понятно, что обнаружение и использование квантовых свойств в структурах живых клеток и организмов — задача на порядки более сложная. Но «кванты» там есть, и это позволяет к ним двигаться. Причём речь идёт не обязательно о вычислениях (хотя идея квантового компьютера в голове звучит любопытно). Наиболее полезное применение «живых» кубитов — это датчики и диагностика. Квантовый МРТ раскрыл бы больше тайн о живом, чем мы узнали к сегодняшнему дню. Например, появление болезни можно было бы отслеживать с квантового уровня — самой тонкой организации материи, до которой добралась современная наука. Наконец, встроить в живую клетку датчик из сверхпроводящего кубита невозможно — она тут же перестанет быть живой. Если говорить об исследовании, то учёные обнаружили квантовые свойства у белка EYFP — улучшенного жёлтого флуоресцентного белка. EYFP обычно используется в биологии как флуоресцентная метка для наблюдения за клетками. В ходе экспериментов с EYFP учёные зафиксировали у него квантовое поведение, которое смогли считывать и контролировать. Квантовые состояния белка считывались с помощью света — как в случае классических сверхпроводящих кубитов, а управлялись микроволновым излучением — это один из распространённых методов переключения квантовых состояний. Белковые кубиты демонстрировали когерентность — состояние суперпозиции и его удержание. Более того, квантовые свойства белок проявлял не только в изолированном виде, но и в составе живых клеток — что невозможно переоценить. По мнению исследователей, новые белковые кубиты пока не столь чувствительны, как лучшие современные квантовые сенсоры, которые часто создаются из алмазов. Однако их истинная сила в том, что они изначально природой предназначены для работы непосредственно в живых клетках. Это открытие расширяет горизонты квантовых технологий, поскольку представляет собой «радикально иной подход к разработке квантовых материалов». И это — не говоря уже о перспективах создания квантовых датчиков в живых организмах. Китайцы научились превращать углекислый газ в сахар
15.07.2025 [10:58],
Геннадий Детинич
Китайские учёные сделали перспективное открытие — они научились эффективно превращать углекислый газ в сложные углеводы: сахар, фруктозу, глюкозу и другие органические вещества, которые могут быть использованы в пищевой и химической промышленности. Разработка одновременно решает две глобальные проблемы: снижение уровня углекислого газа в атмосфере Земли и обеспечение продовольственной безопасности. 
Источник изображения: ИИ-генерация Grok 3/3DNews В процессе разработки технологий преобразования углекислого газа во что-то полезное — топливо, химическое сырьё или даже продукты питания — учёные уже научились эффективно превращать CO₂ в простые молекулы. Однако для конверсии углекислого газа в углеводы и углеводороды, состоящие из длинных цепочек (более 12 атомов углерода), не существовало простых решений. Учёные из Тяньцзиньского института промышленной биотехнологии Академии наук Китая, по их словам, смогли найти приемлемый путь и добились впечатляющих результатов. Казалось бы, Китай, как страна с преимущественно тёплым и влажным климатом (если не учитывать необжитые пустыни и горные районы), способен полностью обеспечивать себя сахаром — тростниковым или свекольным. Однако на практике из 15 млн тонн сахара, ежегодно потребляемого в стране, около 5 млн тонн приходится импортировать. Расширение сельхозугодий под посевы означает дополнительную нагрузку на окружающую среду и чрезмерное использование земель, что в итоге может негативно сказаться на климате. Производство сахара из воздуха стало бы крайне востребованным решением. Учёным удалось создать процесс эффективного синтеза сложных углеводов из CO₂. Сначала в присутствии катализаторов и ферментов синтезируется метанол, а затем на его основе можно получать различные соединения для пищевой и химической промышленности, включая фруктозу, амилозу, амилопектин, целлобиозу и целлоолигосахариды. Эффективность конверсии достигает впечатляющих 86 %, а реакционные цепочки короткие, что значительно сокращает энергозатраты. Перспективный метод преобразования углекислого газа был успешно испытан в лаборатории. Учёные обещают довести технологию до стадии коммерческого производства. Открыта универсальная молекула для лучших дисплеев OLED, датчиков и биотеха
05.07.2025 [10:35],
Геннадий Детинич
Группа учёных во главе с исследователями из Университета Мичигана (University of Michigan) открыла универсальную молекулу для флуоресцентных применений, которая одинаково рекордно эффективна как в твёрдом, так и в жидком состоянии. Такие особенности до предела расширяют сферу её применения от дисплеев до датчиков и визуализации в биологии, одновременно снижая расходы на производство. 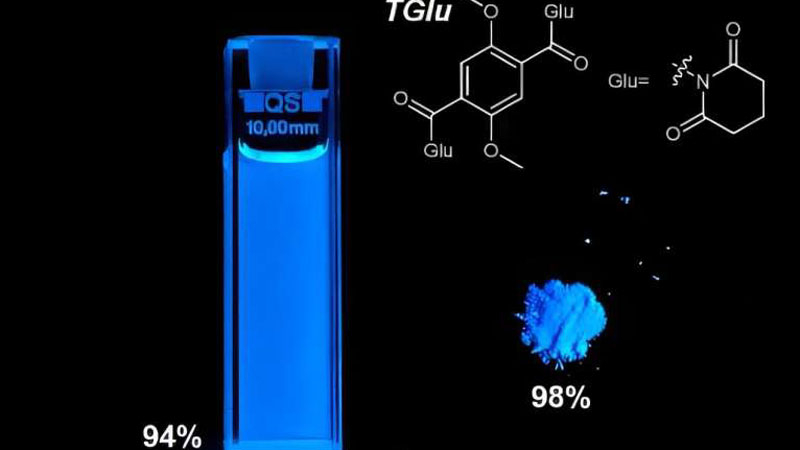
Источник изображения: University of Michigan Большинство исследований в сфере поиска новых светоизлучающих молекул начинается с жидкой фазы, с которой учёным проще работать. Перевод вещества в твёрдую фазу часто настолько сильно изменяет свойство соединений, что оно оказывается неинтересным для дальнейшей разработки, что означает потерянные время и деньги. И если с потерей денег ещё можно смириться, то время — это абсолютно невосполнимый ресурс. Флуоресцентные молекулы, называемые флуорофорами, способны поглощать свет и излучать его на более низких энергетических уровнях (с большими длинами волн). Они обеспечивают свечение пикселей в OLED-дисплеях и помогают врачам и учёным понять, что происходит в клетках и тканях. В дисплеях и в датчиках они должны быть твёрдыми, но для биологических целей обычно используются жидкости. Большинство флуорофоров плохо работают в обеих фазах вещества, но только что открытый флуорофор работает. «Флуоресцентный материал достиг рекордной яркости и эффективности: квантовая эффективность в твёрдом состоянии составила 98 %, а в растворе — 94 %», — сказал Джинсанг Ким (Jinsang Kim), профессор естественных наук и инженерии на факультете материаловедения и инженерии Мичиганского университета, который руководил исследованием. Открытой учёными молекуле дали название TGlu. По факту это одно бензольное кольцо (шесть соединённых в правильный шестиугольник атомов углерода), к которому симметрично с противоположных сторон подсоединены по две группы доноров электронов и акцепторов. За счёт своих малых размеров и тесного расположения источника и приёмника электронов молекула приобретает те удивительные свойства, которые позволяют ей в жидком и твёрдом состоянии быть примерно одинаково эффективной. Интересно, что молекула TGlu была открыта случайно, как часто происходит в научной работе. В исследовании она была не конечным, а промежуточным компонентом. В дальнейшем можно отталкиваться от её структуры и синтезировать новые флуоресцентные вещества. Эта под воздействием возбуждающего видимого света устойчиво испускает свет синей длины волны. Подбирая соединения с другими энергетическими зазорами можно открыть молекулы, светящиеся красным и зелёным светом. Также учёные намерены ввести в соединение TGlu фосфор. Атомы фосфора традиционно более эффективны в флуоресценции. Универсальность молекулы обещает упростить масштабирование при коммерческом производстве таких соединений, что позволит быстрее внедрить открытие для выпуска передовых дисплеев, сенсоров и в биотехе. Учёные научились 3D-печати всяких штук прямо в теле живых организмов
09.05.2025 [16:15],
Геннадий Детинич
Когда-нибудь врачи смогут печатать 3D-заплатки непосредственно в работающих органах, например, в бьющемся сердце, или начнут доставлять лекарства строго к выбранным участкам тела, что необходимо для борьбы со злокачественными опухолями. Для всех этих задач необходимо научиться печать модели глубоко в живых тканях, к чему вплотную приблизились учёные из Калифорнийского технологического института. 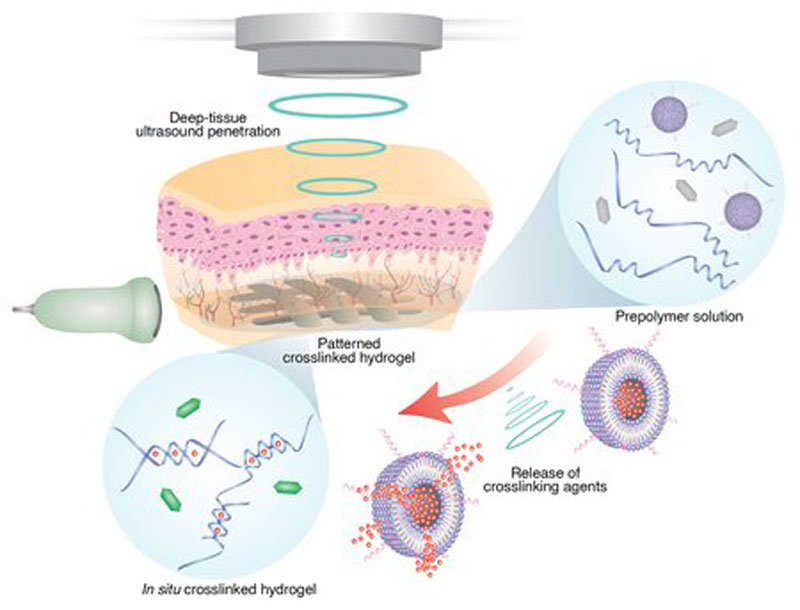
Источник изображений: California Institute of Technology Традиционно для полимеризации 3D-моделей в медицине используется инфракрасный свет. Однако он плохо проникает под кожу и не может активировать полимеры глубоко в тканях. Поэтому учёные из Калтеха сделали ставку на ультразвук. Ультразвук широко применяется для диагностики внутренних органов и при определённых условиях может эффективно воздействовать на полимеры глубоко в теле животных и человека, сохраняя при этом абсолютную биосовместимость. Учёные разработали следующий подход: сочетание ультразвука с липосомами, чувствительными к небольшим перепадам температур. Липосомы представляют собой похожие на клетки сферические пузырьки с несколькими жировыми слоями. Они уже используются в медицине для точечной доставки лекарств. Исследователи загрузили в липосомы сшивающее вещество и погрузили их в раствор полимера, содержащий мономеры. Также в раствор было помещено вещество для создания контраста на ультразвуковом изображении и лекарственный препарат для доставки его в составе будущей 3D-модели. Вместо или вместе с лекарственным препаратом в жидкий ещё раствор полимера можно вносить токопроводящие вещества — серебро или углеродные нанотрубки, которые могут использоваться для создания электродов внутри тела на органах, например, для съёма ЭКГ. 
Примеры 3d-печати ультразвуком внутри тела живых организмов Частицы липосом чувствительны к небольшим изменениям температур. Это означает, что с помощью сфокусированного ультразвукового сигнала можно очень точно повышать температуру на мишени глубоко в живом теле. Достаточно локально повысить температуру всего на 5 ℃, чтобы липосомы высвободили связующие вещества и те начали процесс полимеризации. Контрастное вещество позволяет следить за формой формирующейся в тканях модели и точно корректировать печать. Во время эксперимента на живой мыши учёные напечатали модель с лекарством рядом с опухолевой тканью. Наблюдение показало, что точное внесение препарата с помощью модели оказало более сильное лечебное воздействие, чем простая инъекция того же препарата. «Мы уже показали на примере небольшого животного, что можем печатать гидрогели с лекарственным веществом для лечения опухолей, — заявили учёные. — Наш следующий этап — попытаться напечатать модель в более крупном животном и, надеемся, в ближайшем будущем мы сможем воспроизвести это на людях». Обнаружен новый вид токопроводящих бактерий — в их клетках слишком много никеля
09.05.2025 [14:49],
Геннадий Детинич
На Земле редко встречаются биологические организмы, способные проводить электрический ток. Тем ценнее сделанное открытие — обнаружение нового вида так называемых кабельных бактерий. И это не прихоть природы. Проводимость электронов живыми тканями бактерий участвует в метаболизме организмов, который можно направить в нужное русло, например, очищать среду от загрязнений и развивать биоэлектронику. 
Бактерия Candidatus Electrothrix yaqonensis под микроскопом. Источник изображения: Oregon State University Бактерии найдены в илистых отложениях в устье залива Якуина в штате Орегон учёными местного университета. Бактерии назвали Candidatus Electrothrix yaqonensis в честь коренных народов. Ранее был открыт первый вид бактерий этого рода, но новые заметно отличаются. Возникло даже предположение, что новый вид бактерий — это один из ранних этапов эволюции таких организмов, что обещает лучше понять продвижение редких кабельных бактерий по эволюционной лестнице. Бактерии Ca Electrothrix yaqonensis соединяются в нити. Их нитеобразные колонии могут достигать в длину нескольких сантиметров. Они как настоящие электрические кабели проводят электроны из одного конца в другой. Очевидно, это происходит за счёт высокого содержания никеля в клетках оболочки бактерий. Электроны возникают в анаэробной среде, например, в иле, где нет кислорода, и продвигаются по бактериям во внешнюю среду, богатую кислородом. Это делает бактерии инициаторами окислительно-восстановительных реакций. Они способны взаимодействовать с металлами в среде и нейтрализовать их, очищая тем самым среду обитания и обеспечивая круговорот питательных веществ. Биохимическое применение подобных бактерий также интересует учёных. Живые организмы с электронной проводимостью могут привести к открытиям в области здравоохранения и экологии. Учёные набили тату живым тихоходкам с помощью литографа — это шаг к настоящему чипированию людей и не только
29.04.2025 [10:58],
Геннадий Детинич
В поисках возможностей для производства электронных схем на живых организмах учёные из Датского технического университета (Technical University of Denmark) испытали электронно-лучевую литографию на живых тихоходках — мельчайших организмах со средним размером около 500 мкм. Эта технология создаёт основу для нанесения меток даже на бактерии и открывает путь к созданию датчиков и электронных схем на живой ткани — то есть к настоящему чипированию. 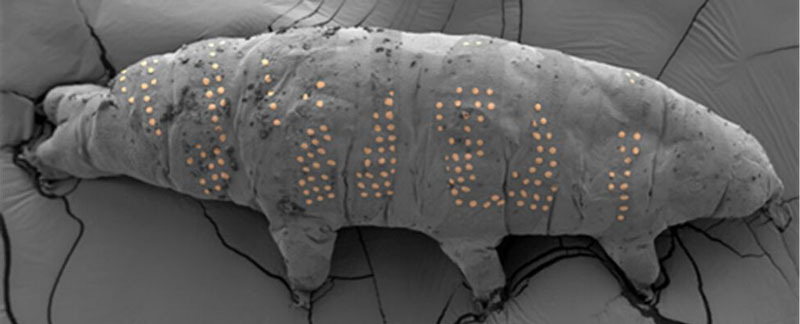
Источник изображения: Nano Letters 2025 «С помощью этой технологии мы не просто создаём микротатуировки на тихоходках, — объясняет инженер-оптик Дин Чжао (Ding Zhao) из Датского технического университета, — мы распространяем эту возможность на различные живые организмы, включая бактерии». Возможность наносить узоры на крошечные объекты и поверхности является важной частью развития нанотехнологий. Полупроводниковая литография в полной мере отражает стремительный рост опыта и достижений в этой области, но работа с живыми тканями едва ли достигла сколь-либо значимого результата. Пожалуй, опыт с нанесением «электронных» татуировок тихоходкам стал первым заметным шагом на этом пути. Для маркировки живых тихоходок учёные воспользовались разновидностью электронно-лучевой литографии, известной как ледяная литография. В ней в качестве резиста — защитного покрытия поверхности перед нанесением рисунка схемы — используется вода или органические растворы. Это создаёт буквально плёнку льда на поверхности, которую электронный луч затем пробивает в заданных местах. Так формируется узор, на который впоследствии осаждается рабочий материал. 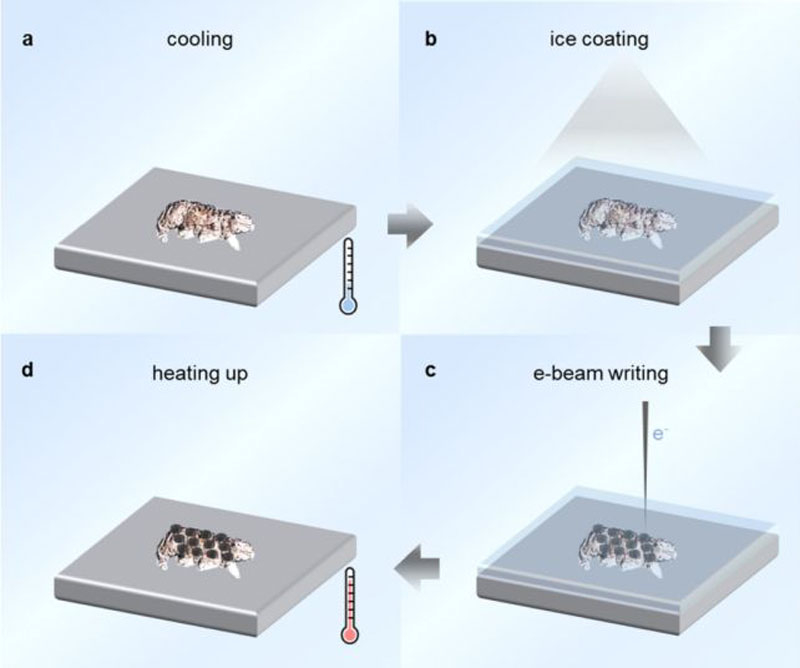 Для такого эксперимента могли подойти только тихоходки. Эти организмы способны выживать в экстремальных условиях — без воды, воздуха и при крайне низких температурах. В подобных условиях они переходят в состояние криптобиоза, обезвоживаются и могут вернуться к жизни при восстановлении благоприятной среды. В сухом виде тихоходки переносят охлаждение до −272 °C. Учёные ввели их в состояние криптобиоза, нанесли на тело вещество анизол, ставшее ледяной плёнкой, и с помощью электронно-лучевой литографии сформировали на поверхности заданный рисунок. Там, где пучок электронов касался ледяной плёнки, образовывался устойчивый узор. Минимальный размер элемента, нанесённого на поверхность тихоходок, составил 72 нм. Эксперимент успешно пережили 40 % подопытных особей. Однако это лишь первый шаг. Технология продемонстрировала свою перспективность, и учёные намерены совершенствовать её для работы с другими организмами. 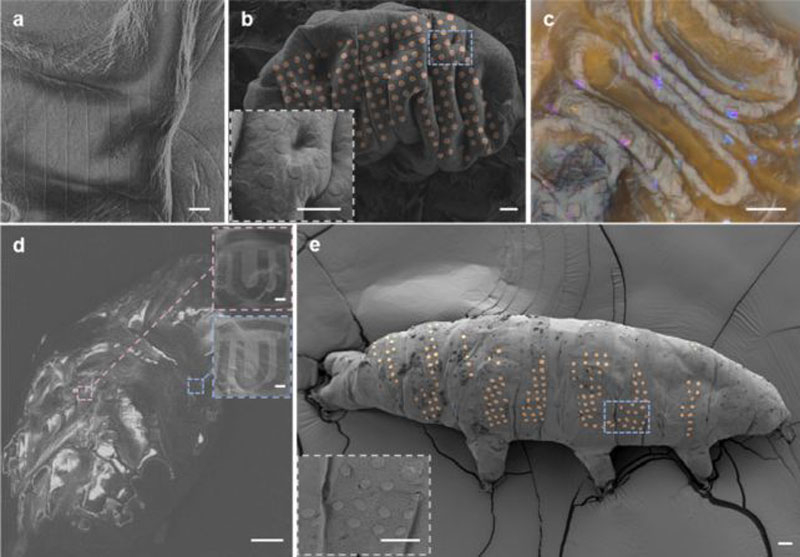 «Мы ожидаем, что интеграция большего количества методов микро- и нанопроизводства с биологически значимыми системами на микро- и наноуровне приведёт к дальнейшему развитию таких областей, как распознавание микроорганизмов, биомиметические устройства и живые микророботы», — пишут учёные в своей работе в журнале Nano Letters. Европа намерена добывать биотопливо для авиации и судоходства с помощью ГМО-микробов
17.04.2025 [15:14],
Геннадий Детинич
В Европе созрело понимание, что авиация и судоходство не могут развиваться, полагаясь исключительно на электрификацию, что связано с переходом на возобновляемые источники энергии. Энергоёмкий транспорт требует топлива, и в условиях полного отказа от ископаемых ресурсов выходом может стать синтетическое горючее. Это соответствует «зелёной» доктрине ЕС и не повлечёт загрязнения окружающей среды. 
Источник изображения: ИИ-генерация Grok 3/3DNews Власти ЕС сообщили, что выделили €8 млн на развитие двух технологий производства «солнечного» топлива в рамках проектов SUN-PERFORM и S2B (Solar to Butanol). В обоих случаях предполагается синтез горючих молекул с помощью генетически модифицированных организмов. На выходе технологии SUN-PERFORM будут получаться липиды (триглицериды), которые с помощью стандартных процессов могут быть преобразованы в биодизельное или экологичное авиационное топливо. Технология S2B нацелена на прямой синтез бутанола, который также может использоваться в качестве топлива. Проект SUN-PERFORM будет развиваться в Нидерландах под руководством Университета Вагенингена (Wageningen University). В консорциум SUN-PERFORM входят ведущие научно-исследовательские и промышленные партнёры, в том числе Университет Билефельда в Германии (Universität Bielefeld), Политехнический университет Турина в Италии (Politecnico di Torino), организация IN SRL Impresa Sociale в Италии, Амстердамский университет в Нидерландах (Universiteit van Amsterdam), SolarFoil BV в Нидерландах и Общество Макса Планка в Германии (Max Planck Society). Испытания будут проводиться на демонстрационных площадках в Нидерландах и Марокко, причём марокканская площадка была выбрана специально для проверки эффективности технологии в условиях высокой солнечной активности. Технология SUN-PERFORM будет сочетать усовершенствованные нанокристаллы, предназначенные для максимального улавливания света, с генетически модифицированными микроводорослями, оптимизированными для производства солнечного топлива. Цель состоит в том, чтобы в четыре раза повысить эффективность преобразования солнечной энергии в топливо, сделав его пригодным для масштабируемого промышленного применения. Координацией проекта S2B занимается Университет Турку в Финляндии (Turun yliopisto — UTU). Технология фокусируется на прямом преобразовании солнечной энергии и атмосферного CO₂ в бутанол — возобновляемое топливо — с помощью генетически модифицированных фотосинтезирующих микроорганизмов и передовых природных (нано)материалов. Консорциум разрабатывает твердотельные фотосинтезирующие биокатализаторы, изготавливаемые с помощью 3D-печати гибридных плёнок. В эти плёнки — функциональные материалы на основе гидрогеля — встраиваются фотосинтезирующие клетки. Эти долговечные и устойчивые платформы для биопроизводства призваны значительно повысить эффективность преобразования света в топливо с захватом CO₂. Партнёрами проекта S2B являются семь ведущих исследовательских организаций и одна компания, занимающаяся инновационным консалтингом, из разных стран Европы: Университет Нанта во Франции (Nantes Université), Королевская высшая техническая школа в Швеции (Kungliga Tekniska högskolan), Академия Або в Финляндии (Åbo Akademi), фонд VU в Нидерландах, Университет Твенте в Нидерландах (Universiteit Twente), Лаппеенрантский технологический университет в Финляндии (Lappeenrannan–Lahden teknillinen yliopisto) и ERDYN Consultants во Франции. В рамках проекта S2B будут разработаны прототипы систем уровня TRL4 (технология подтверждена в лабораторных условиях) с демонстрационными площадками, расположенными в Турку (Финляндия) и Нанте (Франция). Демонстрация обоих проектов состоится в 2028 году, с целью развернуть коммерческое производство к 2029 или 2030 году. Учёные превратили бактерии в гиперспектральные датчики для оценки здоровья растений из космоса
11.04.2025 [14:35],
Геннадий Детинич
Сегодня оценка химического и питательного состава почв, а также состояния здоровья растений проводится в лабораториях с использованием дорогостоящих реагентов. Учёные из США нашли способ дистанционно анализировать такие параметры с помощью одного лишь контроля бактерий. Эти бактерии вырабатывают молекулы, легко различимые гиперспектральными камерами на большом расстоянии и даже с орбиты, что способно кардинально изменить подход к сельскому хозяйству. 
Источник изображения: ИИ-генерация Grok 3/3DNews Генетики давно используют флуоресцентные белки для модификации бактерий. С помощью таких белков бактерии сигнализируют о тех или иных процессах своей жизнедеятельности — это удобно и наглядно. Можно без проведения сложных анализов узнать об уровне ферментов или о состоянии бактериальных колоний. Аналогичным образом бактерии можно обучить распознавать широкий спектр питательных или токсичных веществ, но при этом они должны подавать не обычный световой сигнал, а особый — видимый только гиперспектральными камерами. Гиперспектральные камеры позволяют спутникам получать всестороннюю информацию о почвах, насаждениях и множестве других объектов. Такая технология активно используется с 1970-х годов для дистанционного зондирования Земли. Аналогичным образом спутники или дроны могут считывать гиперспектральные маркеры бактерий, созданных, например, для выявления содержания азота в почве, минеральных веществ в растениях или мышьяка в воде. Учёные из Массачусетского технологического института определили две перспективные для таких задач бактерии и внедрили в их геном комплекс репортёрных генов (reporter genes), который вырабатывает молекулы с чётко выраженным гиперспектральным эффектом в ответ на присутствие специфических соединений в окружающей среде. Тестирование показало, что дроны с гиперспектральными камерами способны улавливать такие маркеры с высоты до 90 метров. Как поясняют исследователи, нет никаких препятствий для того, чтобы заставить бактерии реагировать практически на любые вещества. В перспективе такие бактерии могут использоваться даже для картирования минных полей. Учитывая, что исследование финансировалось Министерством обороны США, Управлением научных исследований армии США и Министерством обороны Израиля, этот вариант может быть реализован одним из первых. |